کنترل کیفی تست رایت (Wright Test Quality Control)
خلاصه: در کنترل کیفی تست رایت، با اجرای منظم کنترلهای مثبت و منفی، بررسی پایداری آنتیژنها، دقت رقتسازی، و صحت تجهیزات (پیپت و بنماری)، اعتبار نتایج تشخیص بروسلوز تضمین میشود. رعایت دمای ۳۷°C، ثبت دقیق دادهها و اقدامات اصلاحی در صورت انحراف، ارکان اصلی «کنترل کیفی تست رایت» هستند.
جهت عضویت در کانال آموزشی در تلگرام به لینک زیر مراجعه کنید:
https://t.me/hematology_education
فهرست مطالب
مقدمه
تست رایت یکی از آزمایشهای سرولوژیک آگلوتیناسیون لولهای است که برای تشخیص بیماری بروسلوز (تب مالت) استفاده میشود. در این آزمایش، آنتیژنهای کشتهشدهی Brucella abortus و Brucella melitensis با سرم بیمار مخلوط میشوند. در صورت وجود آنتیبادیهای اختصاصی، پدیدهی آگلوتیناسیون (رسوب ذرات آنتیژن) رخ میدهد.
جهت مطالعه جامع در مورد روش انجام تست رایت به لینک زیر مراجعه کنید:
روش انجام آزمایش رایت لوله ای: راهنمای جامع برای تشخیص بروسلوز
از آنجا که تست رایت یک آزمایش حساس و وابسته به عوامل متعددی مانند دمای انکوباسیون، دقت در تهیه رقتها و سلامت معرفها است، اجرای منظم و دقیق کنترل کیفی (Quality Control) برای اطمینان از صحت و قابلیت اعتماد نتایج بسیار ضروری است.
اهداف کنترل کیفی تست رایت
- اطمینان از صحت و پایداری آنتیژنها
- بررسی دقت مراحل رقتسازی سرمها
- کنترل عملکرد اپراتور در اجرای صحیح روش آزمایش
- بررسی وضعیت تجهیزات مانند پیپتها، بنماری و لولههای آزمایش
- مقایسه نتایج با کنترلهای مثبت و منفی استاندارد جهت شناسایی انحرافها
انواع کنترل کیفی در تست رایت
۱. کنترل کیفی داخلی تست رایت (Internal Quality Control – IQC)
این نوع کنترل در داخل آزمایشگاه و بهصورت روزانه یا در هر نوبت آزمایش انجام میشود تا از صحت عملکرد روزمره روش اطمینان حاصل گردد.
۲. کنترل کیفی خارجی تست رایت (External Quality Assessment – EQA)
این نوع کنترل توسط مراکز مرجع مانند انستیتو پاستور ایران یا مراکز بهداشت استانی انجام میشود. در این روش نمونههای سرم با تیتر نامشخص برای آزمایشگاه ارسال و نتایج آن با مقدار مرجع مقایسه میشود تا عملکرد کلی آزمایشگاه ارزیابی گردد.
روش انجام کنترل کیفی داخلی تست رایت
هدف
اطمینان از صحت عملکرد آنتیژنها، دقت اپراتور، وسایل اندازهگیری و انکوباتور از طریق اجرای کنترلهای مثبت و منفی با تیتر شناختهشده.
وسایل و مواد مورد نیاز
- آنتیژنهای Brucella abortus و Brucella melitensis (در دمای ۲–۸°C نگهداری شوند)
- سرم کنترل مثبت با تیتر مشخص (مثلاً 1:160 یا 1:320)
- سرم کنترل منفی (فاقد آنتیبادی ضد بروسلوز)
- سرم فیزیولوژی استریل (0.85%)
- لولههای آزمایش 13×100 mm
- میکروپیپت و نوک استریل
- بنماری با دمای 37 ± 0.5°C
- رک لوله، مارکر، تایمر
- فرم ثبت کنترل کیفی
مراحل انجام کار
۱. آمادهسازی اولیه جهت انجام کنترل کیفی تست رایت
- وضعیت ظاهری آنتیژنها بررسی شود (نباید کدر، دوفازی یا دارای رسوب باشند).
- تاریخ انقضا و شماره بچ آنتیژنها ثبت گردد.
- سرم کنترلها را از یخچال خارج کرده و ۱۵ دقیقه در دمای اتاق قرار دهید تا دما یکنواخت شود.
۲. تهیه رقتهای کنترل مثبت
- در ۸ لولهی آزمایش، هرکدام ۰.۵ میلیلیتر سرم فیزیولوژی بریزید.
- در لوله اول، ۰.۵ میلیلیتر از سرم کنترل مثبت اضافه کنید → رقت 1:20.
- ۰.۵ میلیلیتر از لوله اول را به لوله دوم منتقل کنید → رقت 1:40.
- این روند را تا لوله هشتم ادامه دهید تا به رقت 1:2560 برسید.
- در دو سری جداگانه، به هر مجموعه از لولهها ۰.۵ میلیلیتر آنتیژن B. abortus و B. melitensis اضافه کنید.
- لولهها را بهآرامی تکان دهید تا محتویات یکنواخت شوند.
۳. آمادهسازی کنترل منفی جهت کنترل کیفی تست رایت
در یک لوله مجزا، ۰.۵ میلیلیتر سرم فیزیولوژی + ۰.۵ میلیلیتر از هر آنتیژن اضافه کنید (بدون سرم انسانی). در پایان آزمایش این لوله باید شفاف باقی بماند (عدم آگلوتیناسیون).
۴. انکوباسیون
تمام لولهها را در بنماری ۳۷°C به مدت ۲۴ ساعت قرار دهید. در روش سریع (Rapid Wright) میتوان پس از ۲ ساعت نتیجه را خواند، ولی برای کنترل کیفی توصیه میشود انکوباسیون کامل ۲۴ ساعته انجام شود تا ارزیابی دقیقتر صورت گیرد.
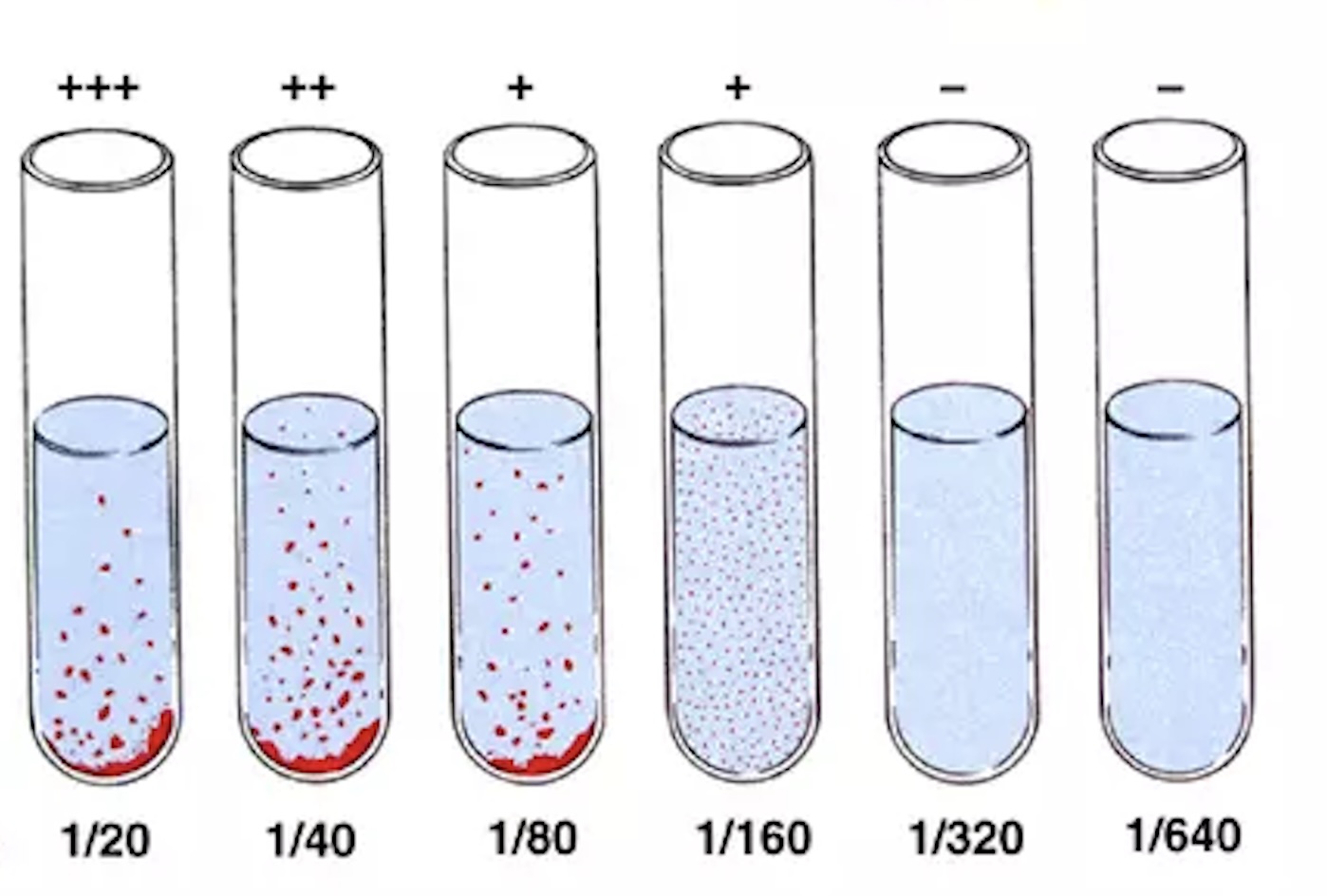
۵. قرائت نتایج
- پس از پایان زمان انکوباسیون، لولهها را بدون تکان دادن زیاد مشاهده کنید.
- حضور یا عدم حضور آگلوتیناسیون را یادداشت کنید.
- برای هر لوله از نشانههای زیر استفاده کنید: (++++)، (+++)، (++)، (+)، (–).
- تیتر نهایی برابر است با بالاترین رقتی که هنوز آگلوتیناسیون قابل مشاهده دارد.
کنترل کیفی تست رایت
۶. ارزیابی نتایج کنترل کیفی تست رایت
| نوع کنترل | محدوده قابل قبول | تفسیر |
|---|---|---|
| کنترل مثبت | تیتر بین 1:160 تا 1:320 (مطابق مشخصات سازنده) | ✅ نتایج معتبر |
| کنترل منفی | بدون آگلوتیناسیون | ✅ نتایج معتبر |
| اختلاف > یک رقت | — | ⚠️ نیاز به بررسی علت و تکرار تست |
| آگلوتیناسیون در کنترل منفی | — | ❌ خطا در کار یا آلودگی؛ تست باطل است |
۷. اقدامات اصلاحی در صورت نتایج غیرمجاز
- بررسی تاریخ انقضا و شرایط نگهداری آنتیژنها.
- کنترل دمای بنماری با ترمومتر کالیبرهشده.
- اطمینان از تمیز بودن کامل لولهها و وسایل شیشهای.
- کنترل و کالیبراسیون مجدد پیپتها.
- در صورت لزوم، تکرار تست با آنتیژن یا سرم کنترل جدید.
۸. مستندسازی کنترل کیفی تست رایت
تمام نتایج کنترلها باید در فرم QC ثبت شوند که شامل موارد زیر است: تاریخ انجام تست، نام اپراتور، شماره بچ آنتیژن، تیتر کنترل مثبت و منفی، دمای انکوباسیون، امضای مسئول فنی.
| تاریخ | آنتیژن | شماره بچ | کنترل مثبت (تیتر) | کنترل منفی | دما (°C) | اپراتور | تأیید فنی |
|---|---|---|---|---|---|---|---|
| — | — | — | — | — | — | — | — |
۹. بایگانی و نگهداری
فرمهای کنترل کیفی داخلی باید حداقل بهمدت دو سال نگهداری شوند و در بازدیدهای تضمین کیفیت (QA Audit) در دسترس باشند.
خطاهای شایع در تست رایت
- استفاده از آنتیژن تاریخ گذشته یا نگهداری در دمای نامناسب
- شستوشوی ناقص وسایل شیشهای
- خطا در تهیه رقتهای سرم
- انکوباسیون در دمای خارج از محدوده استاندارد
- تکان دادن بیش از حد لولهها و از بین رفتن آگلوتیناتها
- تفسیر اشتباه رسوب ظاهری بهعنوان آگلوتیناسیون
جمعبندی
کنترل کیفی دقیق در تست رایت تضمینکننده صحت تشخیص بیماری بروسلوز و اعتبار نتایج آزمایشگاه است. اجرای مستمر کنترلهای مثبت و منفی، ثبت دقیق دادهها و رعایت شرایط نگهداری مواد، سه ستون اصلی کیفیت در این تست هستند. هرگونه انحراف از محدوده قابل قبول باید فوراً شناسایی، علتیابی و اصلاح شود تا نتایج قابل اعتماد برای پزشک و بیمار ارائه گردد.
سؤالات رایج درباره کنترل کیفی تست رایت
۱) کنترل مثبت در تست رایت چه محدودهای باید داشته باشد؟
مطابق کیت و سازنده، معمولاً تیتر 1:160 تا 1:320 قابل قبول است.
۲) اگر کنترل منفی آگلوتیناسیون نشان دهد چه کار باید کرد؟
آلودگی یا خطای کاربر محتمل است؛ وسایل و آنتیژن را تعویض و تست را تکرار کنید.
۳) زمان انکوباسیون استاندارد برای کنترل کیفی چقدر است؟
۲۴ ساعت در ۳۷°C توصیه میشود؛ روش سریع صرفاً غربالگری است.
۴) شایعترین منبع خطا در QC رایت چیست؟
خطای رقتسازی سرم و نگهداری نامناسب آنتیژنها.
۵) هر چند وقت یکبار پیپتها باید کالیبره شوند؟
طبق برنامه تضمین کیفیت آزمایشگاه؛ معمولاً فصلی یا ششماهه.
۶) آیا میتوان از Rapid Wright برای کنترل کیفی استفاده کرد؟
برای کنترل روزانه قابل قبول است، اما بهترین ارزیابی با انکوباسیون ۲۴ ساعته است.
۷) اگر تیتر کنترل مثبت بیش از یک رقت تغییر کند چه میشود؟
خارج از محدوده است؛ علل (آنتیژن، دما، پیپت، اپراتور) را بررسی و تست را تکرار کنید.
۸) فرم QC باید شامل چه مواردی باشد؟
تاریخ، اپراتور، شماره بچ آنتیژن، نتایج کنترلها، دما و تأیید مسئول فنی.
۹) رکوردهای QC چه مدت نگهداری شوند؟
حداقل دو سال برای بازرسیهای QA و ردیابی.
۱۰) دمای بنماری چقدر حساس است؟
۳۷ ± ۰.۵°C؛ انحراف بیشتر میتواند تیترها را تغییر دهد.
