مقاله تخصصی جامع: سیکل اوره (Urea Cycle)
سیکل اوره یا چرخه اوره یکی از بنیادیترین مسیرهای متابولیک بدن انسان است که با تبدیل آمونیاک سمی به اوره، نقش حیاتی در حفظ عملکرد مغز، تعادل نیتروژن و پیشگیری از هایپرآمونمی ایفا میکند. اختلال در این چرخه میتواند منجر به تظاهرات عصبی شدید و تهدیدکننده حیات شود.
جهت عضویت در کانال آموزشی در تلگرام به لینک زیر مراجعه کنید:
https://t.me/hematology_education
فهرست مطالب
چکیده سیکل اوره
چرخه اوره یکی از بنیادیترین و در عین حال حیاتیترین مسیرهای متابولیک در بدن انسان است که وظیفه اصلی آن دفع نیتروژن اضافی حاصل از متابولیسم اسیدهای آمینه میباشد. آمونیاک (Ammonia)، که محصول مستقیم دآمیناسیون اسیدهای آمینه و سایر فرآیندهای نیتروژنی است، یک ترکیب بهشدت سمی بهویژه برای سیستم عصبی مرکزی محسوب میشود. بدن انسان برای جلوگیری از تجمع این ماده، مسیر چرخه اوره را در سلولهای کبدی توسعه داده است تا آمونیاک را به اوره (Urea)، ترکیبی نسبتاً غیرسمی و قابل دفع از طریق کلیهها، تبدیل نماید. هرگونه اختلال در عملکرد آنزیمها یا ناقلهای این چرخه منجر به بروز اختلالات چرخه اوره (Urea Cycle Disorders – UCDs) و هایپرآمونمی (Hyperammonemia) میشود که میتواند با تظاهرات عصبی شدید و حتی مرگ همراه باشد. این مقاله با رویکردی تحلیلی و متنی، چرخه اوره را از سطح مولکولی تا کاربردهای تشخیصی در آزمایشگاه بالینی بهصورت جامع بررسی میکند.
۱. مقدمه: چرا سیکل اوره حیاتی است؟
بدن انسان بهطور مداوم در حال تجزیه پروتئینها و اسیدهای آمینه است. در جریان این فرآیند، گروههای آمینی از اسکلت کربنی اسیدهای آمینه جدا شده و در نهایت به آمونیاک تبدیل میشوند. آمونیاک به دلیل توانایی عبور از سد خونی–مغزی (Blood–Brain Barrier) و تأثیر مستقیم بر متابولیسم نورونها، حتی در غلظتهای نسبتاً پایین نیز میتواند باعث اختلال عملکرد مغز شود. از این رو، حفظ سطح آمونیاک خون در محدوده بسیار باریک، یک ضرورت حیاتی محسوب میشود.
چرخه اوره بهعنوان مسیر اصلی سمزدایی نیتروژن ، نقش محوری در این تعادل ایفا میکند. اهمیت بالینی این چرخه زمانی آشکار میشود که بدانیم بسیاری از نوزادانی که با لتارژی، تشنج یا کمای بدون علت مشخص مراجعه میکنند، در واقع دچار نقص در این مسیر متابولیک هستند.
۲. جایگاه فیزیولوژیک سیکل اوره در بدن
چرخه اوره تقریباً بهطور انحصاری در هپاتوسیتها (Hepatocytes) انجام میشود و نیازمند همکاری دقیق بین میتوکندری (Mitochondria) و سیتوزول (Cytosol) است. آمونیاک تولیدشده در بافتهای محیطی، عمدتاً به شکل گلوتامین (Glutamine) یا آلانین (Alanine) به کبد منتقل میشود. در کبد، این ترکیبات نیتروژن خود را آزاد کرده و وارد چرخه اوره میشوند. اوره تولیدشده سپس وارد جریان خون شده و از طریق کلیهها دفع میگردد.
این وابستگی شدید به کبد توضیح میدهد که چرا نارسایی کبدی پیشرفته میتواند به هایپرآمونمی ثانویه و انسفالوپاتی کبدی (Hepatic Encephalopathy) منجر شود، حتی در غیاب نقص ژنتیکی در آنزیمهای چرخه اوره.
سیکل کربس (چرخه کربس) یا چرخه اسید سیتریک – بررسی جامع مراحل، اهمیت بالینی و کاربردهای آزمایشگاهی
۳. سیکل اوره: شرح متنی و تحلیلی گامبهگام مسیر
چرخه اوره یک مسیر حلقوی متشکل از پنج واکنش آنزیمی متوالی است که دو مرحله نخست آن در ماتریکس میتوکندری و سه مرحله بعدی در سیتوزول سلولهای کبدی انجام میشود.
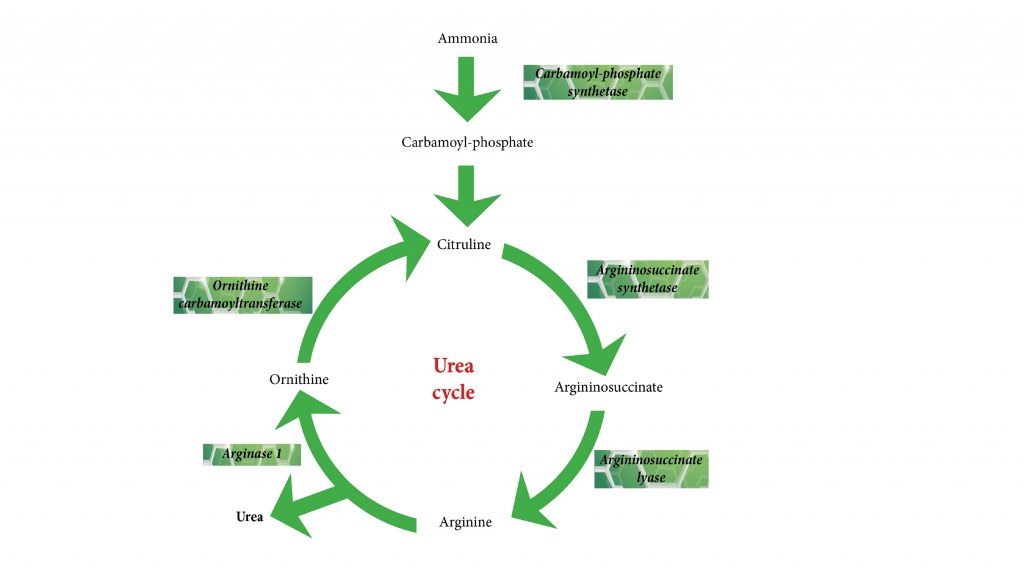
مرحله اول: تشکیل کرباموئیل فسفات (Carbamoyl Phosphate)
این مرحله نقطه آغاز و مهمترین مرحله تنظیمی چرخه اوره محسوب میشود. در ماتریکس میتوکندری، آمونیاک آزادشده با دیاکسید کربن (CO₂) واکنش داده و تحت تأثیر آنزیم کرباموئیل فسفات سنتتاز I (Carbamoyl Phosphate Synthetase I – CPS I) به کرباموئیل فسفات تبدیل میشود. این واکنش نیازمند مصرف دو مولکول ATP بوده و تنها در حضور N-استیل گلوتامات (N-acetylglutamate) بهعنوان فعالکننده آلوستریک انجام میگیرد. بدون N-استیل گلوتامات، این آنزیم عملاً غیرفعال است و کل چرخه متوقف میشود.
کرباموئیل فسفات سنتتاز I تنها آنزیم چرخه اوره است که بهطور مستقیم توسط یک فعالکننده آلوستریک تنظیم میشود.
مرحله دوم: تشکیل سیترولین (Citrulline)
در ادامه، کرباموئیل فسفات با اورنیتین (Ornithine) ترکیب میشود. این واکنش توسط آنزیم اورنیتین ترانسکربامیلاز (Ornithine Transcarbamylase – OTC) کاتالیز شده و منجر به تشکیل سیترولین میگردد. سیترولین سپس از میتوکندری به سیتوزول منتقل میشود. اهمیت این مرحله در آن است که هرگونه نقص در این آنزیم، بهویژه در مردان به دلیل وابستگی به کروموزوم X، میتواند به تجمع شدید آمونیاک منجر شود.
مرحله سوم: سنتز آرژنینوسوکسینات (Argininosuccinate)
در سیتوزول، سیترولین با آسپارتات (Aspartate) وارد واکنش میشود. آسپارتات دومین منبع نیتروژن اوره را فراهم میکند. این واکنش توسط آنزیم آرژنینوسوکسینات سنتتاز (Argininosuccinate Synthetase – ASS1) انجام شده و نیازمند مصرف ATP است که به AMP و پیروفسفات تجزیه میشود. این نکته نشاندهنده هزینه انرژی بالای چرخه اوره است.
مرحله چهارم: شکستن آرژنینوسوکسینات
آرژنینوسوکسینات حاصل، تحت تأثیر آنزیم آرژنینوسوکسینات لیاز (Argininosuccinate Lyase – ASL) به آرژنین (Arginine) و فومارات (Fumarate) تجزیه میشود. فومارات وارد چرخه کربس شده و از طریق مالات و اگزالواستات مجدداً به آسپارتات تبدیل میشود. این ارتباط نزدیک، پیوند متابولیکی چرخه اوره و چرخه کربس را نشان میدهد.
مرحله پنجم: تولید اوره (Urea Formation)
در آخرین مرحله، آرژنین توسط آنزیم آرژیناز (Arginase) هیدرولیز شده و اوره و اورنیتین تولید میشود. اورنیتین مجدداً به میتوکندری بازمیگردد تا چرخه تکرار شود، در حالی که اوره وارد خون شده و از طریق کلیهها دفع میگردد.
۴. تنظیم سیکل اوره (Urea Cycle Regulation)
تنظیم چرخه اوره برای تطابق بدن با تغییرات بار نیتروژنی، وضعیت تغذیهای و شرایط استرس متابولیک ضروری است. این تنظیم در دو سطح اصلی، یعنی تنظیم سریع (کوتاهمدت) و تنظیم آهسته (بلندمدت)، انجام میشود و تضمین میکند که دفع آمونیاک متناسب با تولید آن باشد.
در تنظیم کوتاهمدت، نقش محوری بر عهده N-استیل گلوتامات (N-acetylglutamate) است. این مولکول که در ماتریکس میتوکندری ساخته میشود، فعالکنندهٔ آلوستریک الزامی آنزیم کرباموئیل فسفات سنتتاز I است. سطح N-استیل گلوتامات بهطور مستقیم تحت تأثیر غلظت آرژنین قرار دارد؛ به این معنا که افزایش ورود اسیدهای آمینه به کبد، باعث افزایش آرژنین و در نتیجه فعال شدن چرخه اوره میشود. این مکانیسم نوعی «حسگر نیتروژن» محسوب میشود که اجازه نمیدهد آمونیاک در شرایط پرپروتئین تجمع یابد.
در تنظیم بلندمدت، بیان ژنهای کدکننده آنزیمهای چرخه اوره تغییر میکند. رژیمهای غذایی پرپروتئین باعث افزایش رونویسی ژنهایی مانند CPS1، OTC، ASS1 و ASL میشوند، در حالی که رژیمهای کمپروتئین یا وضعیت آنابولیک ناشی از انسولین، بیان این آنزیمها را کاهش میدهد. هورمونهای گلوکوکورتیکوئیدی نیز در شرایط استرس و گرسنگی با افزایش بیان این ژنها، دفع نیتروژن را تسهیل میکنند. این نوع تنظیم توضیح میدهد که چرا تطابق متابولیک با رژیم غذایی چند روز زمان میبرد.
از منظر بالینی، اختلال در تنظیم چرخه اوره، حتی در غیاب نقص ژنتیکی، میتواند منجر به هایپرآمونمی شود. بهعنوان مثال، مصرف برخی داروها، عفونت شدید یا کاتابولیسم بالا میتواند ظرفیت چرخه اوره را موقتاً ناکافی کند.
۵. اختلالات سیکل اوره و پیامدهای بالینی
اختلالات چرخه اوره گروهی از بیماریهای متابولیک ارثی هستند که به دلیل نقص در یکی از آنزیمها یا ناقلهای دخیل در این مسیر ایجاد میشوند. نتیجه مشترک تمامی این اختلالات، ناتوانی بدن در تبدیل مؤثر آمونیاک به اوره و در نهایت بروز هایپرآمونمی است. شدت تظاهرات بالینی به میزان باقیمانده فعالیت آنزیم و سن بیمار بستگی دارد.
در فرمهای شدید که معمولاً در دوره نوزادی تظاهر مییابند، نوزاد پس از شروع تغذیه دچار بیحالی، استفراغ، تنفس سریع و کاهش سطح هوشیاری میشود. این علائم بهسرعت میتوانند به تشنج و کما منجر شوند. در این بیماران، سطح آمونیاک خون اغلب بهطور قابلتوجهی افزایش یافته و یک اورژانس متابولیک واقعی ایجاد میکند.
در مقابل، فرمهای خفیفتر یا نقصهای نسبی آنزیمها ممکن است در کودکی یا حتی بزرگسالی ظاهر شوند. این بیماران اغلب سابقه عدم تحمل پروتئین، استفراغهای دورهای، سردرد، اختلالات رفتاری یا کاهش عملکرد تحصیلی دارند. نکته مهم این است که در این موارد، تشخیص اغلب با تأخیر انجام میشود، زیرا علائم میتوانند غیر اختصاصی باشند.
از دیدگاه پاتوفیزیولوژیک، تجمع آمونیاک باعث افزایش سنتز گلوتامین در آستروسیتهای مغز میشود. این امر منجر به ادم سلولی، افزایش فشار داخل جمجمه و اختلال انتقالدهندههای عصبی میگردد. به همین دلیل، علائم عصبی شاخصترین تظاهر اختلالات چرخه اوره هستند.
۶. رویکرد تشخیصی آزمایشگاهی
تشخیص اختلالات چرخه اوره بدون تکیه بر دادههای آزمایشگاهی عملاً امکانپذیر نیست. اولین و مهمترین آزمایش در هر بیمار با علائم عصبی غیرقابل توضیح، اندازهگیری آمونیاک خون است. افزایش آمونیاک، بهویژه در حضور pH طبیعی یا آلکالوز تنفسی، زنگ خطر جدی برای وجود نقص در چرخه اوره محسوب میشود.
پس از تأیید هایپرآمونمی، بررسی پروفایل اسیدهای آمینه پلاسما نقش تعیینکنندهای در افتراق انواع مختلف UCD دارد. کاهش سیترولین معمولاً به نفع نقصهای میتوکندریایی مانند CPS I یا OTC است، در حالی که افزایش شدید سیترولین بهطور شاخص در کمبود آرژنینوسوکسینات سنتتاز دیده میشود. افزایش آرژنینوسوکسینات یا آرژنین نیز میتواند مسیر تشخیص را به سمت نقصهای پاییندست چرخه هدایت کند.
آنالیز اسیدهای آلی ادرار، بهویژه اندازهگیری اوروتیک اسید (Orotic acid)، ابزار مهم دیگری در تشخیص است. افزایش اوروتیک اسید نشاندهنده ورود بیش از حد کرباموئیل فسفات به مسیر سنتز پیریمیدینهاست که معمولاً در نقص OTC مشاهده میشود. این یافته به افتراق بین نقصهای CPS I و OTC کمک شایانی میکند.
در نهایت، تشخیص قطعی بر اساس بررسیهای ژنتیکی و شناسایی جهش مسئول بیماری انجام میشود. با این حال، از دیدگاه بالینی، تصمیمگیری درمانی نباید منتظر نتایج ژنتیکی بماند و آزمایشگاه نقش حیاتی در تشخیص سریع و هدایت درمان اولیه ایفا میکند.
۷. نتیجهگیری
چرخه اوره نمونهای بارز از پیوند عمیق بیوشیمی با پزشکی بالینی است. درک دقیق این مسیر نهتنها برای دانشجویان و متخصصان بیوشیمی، بلکه برای تمامی فعالان علوم آزمایشگاهی ضروری است، چرا که تشخیص بهموقع و تفسیر صحیح نتایج آزمایشگاهی میتواند جان بیماران مبتلا به اختلالات چرخه اوره را نجات دهد.
واژهنامه کلیدی
چرخه اوره، هایپرآمونمی، انسفالوپاتی متابولیک، اختلالات متابولیک ارثی، اسیدهای آمینه پلاسما، اسیدهای آلی ادرار
سؤالات رایج درباره سیکل اوره
۱. چرخه اوره چیست؟
چرخه اوره مسیر متابولیکی اصلی دفع آمونیاک و تبدیل آن به اوره در کبد است.
۲. چرا آمونیاک برای مغز سمی است؟
به دلیل عبور از سد خونی–مغزی و ایجاد اختلال در متابولیسم نورونها.
۳. چرخه اوره در کدام اندام انجام میشود؟
تقریباً بهطور انحصاری در کبد.
۴. مهمترین آزمایش تشخیصی اختلالات چرخه اوره چیست؟
اندازهگیری آمونیاک خون.
۵. افزایش اوروتیک اسید نشاندهنده چیست؟
معمولاً نقص آنزیم OTC.
۶. چرا نوزادان زودتر دچار علائم میشوند؟
به دلیل فقدان ظرفیت جبرانی متابولیک.
۷. نقش آسپارتات در چرخه اوره چیست؟
تأمین دومین اتم نیتروژن اوره.
۸. ارتباط چرخه اوره و چرخه کربس چیست؟
از طریق فومارات و آسپارتات.
۹. آیا بزرگسالان هم میتوانند UCD داشته باشند؟
بله، در فرمهای خفیف یا نسبی.
۱۰. چرا تشخیص سریع اهمیت دارد؟
برای پیشگیری از آسیب مغزی غیرقابل برگشت.
منابع معتبر برای مطالعه بیشتر
