مدیریت خون بیمار (Patient Blood Management – PBM)
خلاصه کوتاه: مدیریت خون بیمار به معنای رویکردی چندرشتهای، مبتنی بر شواهد و متمرکز بر بیمار برای بهینهسازی وضعیت خون، کاهش نیاز به انتقال و ارتقای ایمنی و نتایج بالینی است. PBM با سه ستونِ درمان کمخونی، پیشگیری/کاهش خونریزی و افزایش تحمل کمخونی، تصمیمگیری انتقال خون را از «عادت» به «دادهمحور» تبدیل میکند و شاخصهای کیفیت و اقتصادی نظام سلامت را بهبود میدهد.
جهت عضویت در کانال آموزشی در تلگرام به لینک زیر مراجعه کنید:
https://t.me/hematology_education
فهرست مطالب
- بخش اول: مقدمه و کلیات مدیریت خون بیمار (Patient Blood Management)
- بخش دوم: مبانی علمی و فیزیولوژیک مدیریت خون بیمار
- بخش سوم: ارکان اصلی مدیریت خون بیمار (سه ستون طلایی PBM)
- بخش چهارم: استراتژیها و مراحل اجرایی پیادهسازی PBM
- بخش پنجم: کاربردهای PBM در حوزههای بالینی مختلف
- بخش ششم: نقش آزمایشگاه و بانک خون در PBM
- بخش هفتم: شاخصها، نتایج و شواهد علمی PBM
- بخش هشتم: چالشها، موانع و چشمانداز آینده PBM
- سوالات متداول (FAQ)
- منابع معتبر برای مطالعه بیشتر
جهت مطالعه ی مقالات ایمونوهماتولوژی و بانک خون وب سایت هموستیکا به لینک زیر مراجعه کنید:
مقالات ایمونوهماتولوژی و بانک خون
🩸 بخش اول: مقدمه و کلیات مدیریت خون بیمار (Patient Blood Management)
تعریف و مفهوم کلی
مدیریت خون بیمار یا Patient Blood Management (PBM) یک رویکرد چندرشتهای، مبتنی بر شواهد و متمرکز بر بیمار است که هدف آن بهینهسازی استفاده از خون و فرآوردههای خونی، کاهش اتلاف منابع، و بهبود نتایج بالینی بیماران است.
PBM نهتنها جایگزینی برای انتقال خون نیست، بلکه چارچوبی نظاممند برای تصمیمگیری منطقی دربارهی زمان و نحوهی استفاده از خون است.
در واقع، PBM مفهومی فراتر از “مدیریت انتقال خون” دارد. در این رویکرد، هدف تنها حفظ موجودی خون یا کاهش هزینهها نیست، بلکه تمرکز بر حفظ سلامت فیزیولوژیک بیمار و پیشگیری از کمخونی یا خونریزی از ابتداست.
سازمان جهانی بهداشت (WHO) در راهنمای رسمی خود در سال ۲۰۲۳ تعریف میکند: «مدیریت خون بیمار یک استراتژی نظاممند و چندبخشی است که از مداخلات مبتنی بر شواهد برای حفظ، بهبود یا جایگزینی خون بیمار استفاده میکند تا نتایج درمانی بهینه و ایمنی بیمار تضمین شود.»
تاریخچه و تکامل PBM
پیش از ظهور مفهوم PBM، سیاست غالب در بیمارستانها بر پایهی در دسترس بودن خون و تصمیمگیری سریع برای انتقال در شرایط کاهش هموگلوبین بود.
تا دههی ۱۹۹۰، تصور بر این بود که “انتقال خون = نجات جان بیمار”.
اما با پیشرفت دانش هماتولوژی، فیزیولوژی اکسیژنرسانی و شناخت بهتر از عوارض انتقال خون، دیدگاهها تغییر کرد.
در اوایل دههی ۲۰۰۰، استرالیا نخستین کشوری بود که برنامهی ملی PBM را تدوین کرد.
نتایج اجرای آن چشمگیر بود:
* کاهش ۴۱٪ در مصرف گلبول قرمز
* کاهش ۲۸٪ در مرگومیر بیماران جراحی
* و صرفهجویی میلیونها دلار در سال از بودجه سلامت
به دنبال آن، کشورهای اروپایی، آمریکا، کانادا و سپس سازمان جهانی بهداشت در سال ۲۰۲۳، PBM را بهعنوان استاندارد جهانی مراقبت معرفی کردند.
امروزه PBM نهتنها در جراحیهای بزرگ، بلکه در ICU، زنان و زایمان، بیماران مزمن و حتی درمانهای سرپایی نیز اجرا میشود.
ضرورت و اهمیت PBM در نظام سلامت
خون، برخلاف بسیاری از داروها، منبعی محدود، وابسته به داوطلبان و پرهزینه است.
فرآیند جمعآوری، غربالگری، فرآوری، نگهداری و توزیع آن، بهطور مستقیم منابع انسانی، زیرساختی و مالی گستردهای را درگیر میکند.
اما مهمتر از هزینه، عوارض انتقال خون است که در بسیاری از مطالعات علمی تأیید شدهاند:
عوارض مستقیم انتقال خون
- واکنشهای همولیتیک حاد یا تأخیری
- انتقال عفونتها (ویروسی، باکتریایی)
- TRALI (آسیب ریوی حاد ناشی از انتقال خون)
- TACO (افزایش حجم مایعات و فشار ریوی)
- واکنشهای تبزا، آلرژیک یا آنافیلاکسی
عوارض غیرمستقیم و تأخیری
- سرکوب سیستم ایمنی بیمار (Transfusion-related immunomodulation)
- افزایش خطر عفونتهای بعد از عمل
- افزایش مرگومیر و طول بستری
- احتمال تحریک رشد تومور در بیماران سرطانی
در یک مطالعهی مرجع (Murphy et al., NEJM, 2015)، مشخص شد که هر واحد خون اضافی که بدون اندیکاسیون قطعی تزریق شود، خطر مرگ بیمار را تا ۲۵٪ افزایش میدهد.
“`
تفاوت PBM با مدیریت سنتی انتقال خون
| ویژگی | مدیریت سنتی انتقال خون | مدیریت خون بیمار (PBM) |
|---|---|---|
| هدف اصلی | تأمین واحدهای خون کافی برای بیماران | پیشگیری از نیاز به انتقال خون |
| نقطه تمرکز | بانک خون و فرآیند تأمین خون | بیمار و وضعیت فیزیولوژیک او |
| زمان مداخله | پس از بروز کمخونی یا خونریزی | پیش از بروز مشکل (پیشگیرانه) |
| تصمیمگیری | توسط بانک خون یا پزشک معالج | توسط تیم چندرشتهای (PBM Team) |
| شاخص موفقیت | حجم خون تأمینشده | بهبود Hb، کاهش انتقال و کاهش عوارض |
اهداف و فلسفه PBM
- بهینهسازی تولید گلبول قرمز بیمار (Erythropoiesis): شناسایی و درمان کمخونی قبل از جراحی یا بستری. استفاده از آهن تزریقی، ویتامینها و عوامل محرک اریتروپوئز (ESA).
- کاهش از دست رفتن خون: پیشگیری از خونریزی در تمام مراحل درمان (قبل، حین و بعد از عمل) با کنترل داروها، تکنیکهای جراحی و استفاده از آنتیفیبرینولیتیکها.
- افزایش تحمل بیمار نسبت به کمخونی: استفاده از راهکارهای فیزیولوژیک مانند بهینهسازی همودینامیک، اکسیژنتراپی و تنظیم آستانه انتقال خون.
- ارتقای ایمنی بیمار: کاهش خطرات ناشی از انتقال خون و عفونتهای بیمارستانی.
- کاهش هزینه و مصرف منابع: کاهش نیاز به فرآوردههای خونی، صرفهجویی اقتصادی و تخصیص بهتر منابع.
- پایداری در نظام سلامت: اطمینان از وجود خون کافی برای بیماران حیاتی و اورژانسی، بدون اتلاف منابع.
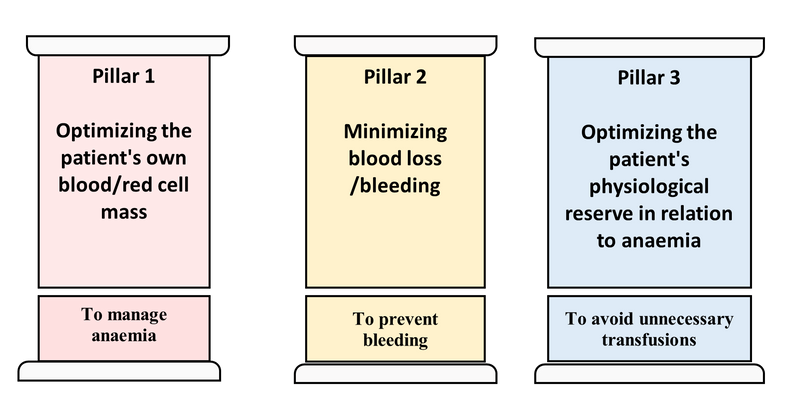
سه رکن اصلی مدیریت خون بیمار
نقش WHO در ترویج PBM
سازمان جهانی بهداشت (WHO) در سال ۲۰۲۳ راهنمای رسمی خود را با عنوان
“Guidance on Implementing Patient Blood Management to Improve Global Blood Health Status” منتشر کرد.
این سند برای اولینبار PBM را بهعنوان یک استاندارد مراقبتی جهانی معرفی نمود.
WHO تأکید دارد که:
– PBM باید بهعنوان بخشی از سیاست سلامت ملی کشورها اجرا شود.
– اجرای آن باید چندمرحلهای (آمادهسازی، پایلوت، استقرار سراسری) باشد.
– شاخصهای کلیدی عملکرد (KPIs) مثل میزان Hb قبل از عمل و میانگین واحد خون مصرفی باید پایش شوند.
– آموزش و فرهنگسازی در تیمهای جراحی، بیهوشی و آزمایشگاه از ارکان کلیدی موفقیت است.
نقش بیمارستان و تیم چندرشتهای
PBM یک کار گروهی است، نه فردی.
در هر بیمارستان، باید کمیته PBM تشکیل شود که اعضای آن عبارتاند از:
– متخصص هماتولوژی یا انتقال خون
– پزشک بیهوشی و جراح
– پرستار اتاق عمل و ICU
– کارشناس بانک خون
– مسئول کنترل عفونت و کیفیت
– و در مراکز بزرگ، اپیدمیولوژیست بالینی یا کارشناس آمار
هر عضو نقش خاصی دارد:
– جراح: ارزیابی خونریزی و تصمیم برای تکنیکهای کمتهاجمی
– بیهوشی: حفظ همودینامیک و کاهش رقیقسازی خون
– آزمایشگاه: تشخیص سریع کمخونی، کنترل هموستاز
– بانک خون: ارزیابی موجودی و تطابق ایمن
– تیم کنترل کیفیت: پایش شاخصها و ثبت دادهها
بیمار محور بودن PBM
PBM برخلاف سیستم سنتی، رویکردی متمرکز بر بیمار دارد.
در این مدل، هر تصمیم بالینی باید بر اساس نیاز واقعی فیزیولوژیک بیمار گرفته شود.
برای مثال:
– آستانه انتقال خون در بیمار جوان سالم ممکن است ۷ g/dL باشد،
اما در بیمار قلبی با ایسکمی فعال، آستانه ممکن است ۸ یا ۹ g/dL باشد.
در PBM، «یک عدد ثابت برای همه بیماران» وجود ندارد؛ بلکه شرایط بالینی، فیزیولوژی و خطرات هر بیمار بهصورت شخصیسازیشده در نظر گرفته میشود.
تغییر نگرش از “انتقال” به “حفظ خون”
در قرن بیستم، شاخص موفقیت بانک خون بر اساس تعداد واحدهای انتقالی بود.
اما در قرن بیستویکم، شاخص موفقیت PBM بر اساس تعداد بیمارانی است که بدون نیاز به انتقال خون، با Hb پایدار و بدون عارضه ترخیص میشوند.
مسیر پیش رو در اجرای PBM
با وجود موفقیتهای جهانی، هنوز در بسیاری از کشورها PBM بهطور کامل اجرا نشده است.
دلایل اصلی عبارتاند از:
– نبود آموزش کافی در کادر درمان
– تمرکز بیش از حد بر “تأمین خون” به جای “مدیریت خون بیمار”
– کمبود زیرساختهای آزمایشگاهی و سیستمهای پایش دادهها
– و نبود فرهنگ سازمانی برای کار تیمی چندرشتهای
با این حال، کشورهای موفق (مثل استرالیا، آلمان، هلند) نشان دادهاند که با طراحی ساختار منظم، میتوان در کمتر از ۵ سال مصرف خون را تا ۳۰–۴۰٪ کاهش داد بدون آنکه سلامت بیماران به خطر بیفتد.
🧬 بخش دوم: مبانی علمی و فیزیولوژیک مدیریت خون بیمار (Patient Blood Management)
فیزیولوژی خون و اهمیت آن در حیات بدن
خون یکی از پیچیدهترین بافتهای زنده در بدن است که علاوه بر حمل اکسیژن، در تنظیم pH، انتقال مواد مغذی، دفاع ایمنی و حفظ هموستاز نقش حیاتی دارد. هر میلیلیتر خون حاوی میلیاردها سلول خونی است که در تعامل با پلاسما، سیستم ایمنی و عروق، اکسیژن را به بافتها منتقل کرده و دیاکسیدکربن را بازمیگرداند.
در فرد بالغ، حجم خون حدود ۷٪ وزن بدن است (تقریباً ۵ لیتر برای فردی با وزن ۷۰ کیلوگرم).
از این مقدار:
– حدود ۴۵٪ را سلولها (عمدتاً گلبول قرمز) تشکیل میدهند.
– حدود ۵۵٪ پلاسما است که حاوی پروتئینها، فاکتورهای انعقادی و مواد مغذی است.
گلبول قرمز با دارا بودن هموگلوبین، اصلیترین عامل انتقال اکسیژن محسوب میشود. هر گرم هموگلوبین قادر است حدود ۱.۳۴ میلیلیتر اکسیژن را به خود متصل کند. بنابراین هرگونه کاهش در تعداد یا عملکرد گلبول قرمز، مستقیماً بر انتقال اکسیژن و حیات سلولی تأثیر میگذارد.
مفهوم اکسیژنرسانی و ظرفیت حمل اکسیژن
اکسیژنرسانی (Oxygen Delivery, DO₂) برابر است با مقدار اکسیژنی که در هر دقیقه به بافتها میرسد و از رابطه زیر تبعیت میکند:
DO₂ = CO × CaO₂ , CaO₂ = (1.34 × Hb × SaO₂) + (0.003 × PaO₂)
بدین ترتیب، ظرفیت اکسیژنرسانی بدن بهشدت وابسته به سه عامل است:
1) غلظت هموگلوبین
2) درصد اشباع اکسیژن هموگلوبین (SaO₂)
3) برونده قلب
حتی اگر اکسیژن و قلب بهخوبی عمل کنند، کمبود هموگلوبین باعث افت شدید DO₂ میشود.
پاتوفیزیولوژی کمخونی و خونریزی
تأثیر کمخونی
وقتی غلظت هموگلوبین کاهش مییابد، توانایی بدن برای رساندن اکسیژن به بافتها نیز افت میکند. در پاسخ به این حالت، بدن چند مکانیسم جبرانی فعال میکند:
– افزایش برونده قلب
– افزایش برداشت اکسیژن توسط بافتها
– جابجایی منحنی تفکیک اکسیژن-هموگلوبین (بهسمت راست)
– افزایش تولید ۲,۳-DPG در گلبول قرمز
اما اگر کمخونی شدید شود (Hb زیر ۷ g/dL)، این جبرانات کافی نخواهد بود و بافتها دچار هیپوکسی و آسیب سلولی میشوند.
در بیماران قلبی یا سالخورده، حتی Hb ۸–۹ g/dL ممکن است بحرانی باشد.
تأثیر خونریزی حاد
در خونریزی سریع، مشکل تنها کاهش هموگلوبین نیست، بلکه کاهش حجم گردش خون (Hypovolemia) نیز باعث افت فشار، کاهش پرفیوژن بافتی و شوک میشود.
در چنین شرایطی، درمان فوری با مایعات کریستالوئید، کلوئید و در صورت نیاز خون ضروری است.
اما PBM توصیه میکند که ابتدا حجم و هموستاز اصلاح شود و انتقال خون تنها زمانی انجام شود که مکانیسمهای جبرانی دیگر کافی نباشند.
هموستاز: تعادل حیاتی بین خونریزی و لخته شدن
مراحل هموستاز طبیعی
- انقباض عروقی (Vasoconstriction): پاسخ فوری به آسیب عروقی که با کاهش جریان خون موضعی همراه است.
- هموستاز اولیه (پلاکتی): چسبیدن پلاکتها به ناحیه آسیب، فعالسازی و تشکیل پلاک اولیه. این مرحله وابسته به فاکتور فونویلبراند (vWF) و گیرنده GPIb است.
- هموستاز ثانویه (انعقادی): فعالسازی مسیرهای درونی و بیرونی انعقاد و تشکیل فیبرین. کلیدیترین فاکتورها: VII, X, V, II (پروترومبین) و فیبرینوژن.
- فیبرینولیز و ترمیم: پس از لخته شدن، سیستم فیبرینولیتیک فعال میشود تا لخته بهموقع حل گردد.
اهمیت هموستاز در مدیریت خون بیمار
مدیریت خون بیمار باید توازن دقیقی بین جلوگیری از خونریزی و پرهیز از لختهزایی بیش از حد برقرار کند.
بهعنوان مثال:
– قطع یا تعدیل داروهای ضد انعقادی (وارفارین، DOACs) قبل از جراحی
– پایش دقیق PT، aPTT، فیبرینوژن و پلاکت پیش از عمل
– استفاده از داروهای ضد فیبرینولیتیک مانند ترانکسامیک اسید در جراحیهای بزرگ
هموستاز و نقش فیزیولوژیک پلاکتها
پلاکتها نهتنها در لخته شدن نقش دارند بلکه در حفظ تمامیت عروقی و التهاب نیز دخیلاند.
در جراحیها یا تروما، کاهش پلاکت (< 100,000/µL) خطر خونریزی را افزایش میدهد.
اما تزریق پلاکت بدون اندیکاسیون میتواند خطر ترومبوز را بالا ببرد.
PBM به جای تزریق کورکورانه پلاکت، بر اصلاح علت کاهش پلاکت تأکید دارد، مانند:
– قطع داروی ضد پلاکتی
– درمان سپسیس یا DIC
– استفاده هدفمند از پلاکت تنها زمانی که خونریزی فعال و شمارش پایین وجود دارد.
فاکتورهای مؤثر بر اکسیژنرسانی در کمخونی
| عامل | اثر بر اکسیژنرسانی | مداخله در PBM |
|---|---|---|
| برونده قلب | افزایش برونده، جبران افت Hb | بهینهسازی حجم و عملکرد قلب |
| PaO₂ | کاهش آن باعث افت DO₂ | اکسیژنتراپی، تهویه کنترلشده |
| ۲,۳-DPG | افزایش آن، آزادسازی O₂ را تسهیل | جلوگیری از اسیدوز شدید و هیپوترمی |
| ویسکوزیته خون | کاهش بیش از حد، اختلال در توزیع O₂ | کنترل مایعات و هماتوکریت |
| دمای بدن | هیپوترمی آزادسازی O₂ را کم میکند | گرمکردن بیمار حین جراحی |
پاسخهای فیزیولوژیک به از دست رفتن خون
- فاز هیپوولمی اولیه: افزایش ضربان و انقباض عروقی.
- فاز جبران متابولیک: افزایش برداشت O₂ و بالا رفتن لاکتات.
- فاز شوک: ادامه خونریزی → افت فشار، هیپوکسی، نارسایی چند اندام.
در PBM، مداخله باید پیش از ورود بیمار به فاز شوک انجام شود.
خطرات فیزیولوژیک انتقال خون بیش از حد
- اختلالات متابولیک: هیپرکالمی، هیپوکلسمی (سیترات)، هیپوترمی و اختلال انعقادی.
- اثرات ایمنی و التهابی: TRIM و افزایش عفونتها، تأخیر ترمیم زخم.
- افزایش ویسکوزیته و کاهش میکروپرفیوژن: تزریق زیاد RBC میتواند مقاومت عروقی را افزایش و جریان مویرگی را کاهش دهد.
ارتباط بین فیزیولوژی و تصمیم بالینی
تصمیمگیری برای تزریق خون باید بر اساس اکسیژنرسانی واقعی بافتها و نه صرفاً عدد Hb انجام شود. مثال: دو بیمار با Hb=8؛ یکی پایدار و بدون علائم → احتمالاً بینیاز از انتقال. دیگری با درد قفسه سینه و افت فشار → احتمالاً نیازمند انتقال.
نقش آزمایشگاه در پایش وضعیت خون و اکسیژنرسانی
CBC دقیق، فریتین/آهن/B12/فولات، PT/aPTT/فیبرینوژن/PLT، لاکتات، و POCT (ROTEM/TEG) در اتاق عمل و ICU از ارکان کلیدیاند.
اهمیت حفظ دمای بدن و پیشگیری از هیپوترمی
کاهش ۱ درجه سانتیگراد میتواند فعالیت پلاکتی را تا ۱۰٪ کم کند. گرم نگهداشتن بیمار یکی از اصول پایه PBM است.
تعادل بین کریستالوئید، کلوئید و فرآوردههای خونی
انتخاب مایع جایگزین: کریستالوئیدها برای احیای اولیه، کلوئیدها در حفظ حجم (با احتیاط)، خون فقط با اندیکاسیون ثابت. هدف، پرفیوژن مؤثر بدون اتلاف منابع خونی است.
جمعبندی بخش دوم
درک فیزیولوژی اکسیژنرسانی، هموستاز و پاسخ بدن به خونریزی اساس PBM است. تصمیمات درمانی باید فیزیولوژیک و فردمحور باشند، نه صرفاً مبتنی بر یک عدد Hb.
🩸 بخش سوم: ارکان اصلی مدیریت خون بیمار (سه ستون طلایی PBM)
مقدمه
هستهٔ اصلی مدیریت خون بیمار بر سه ستون علمی و عملی استوار است که در تمامی بیماران (جراحی، بستری، مزمن یا سرپایی) قابل اجراست.
این ارکان بر اساس چارچوب سازمان جهانی بهداشت (WHO, 2023) و استانداردهای SABM (2021) تدوین شدهاند و عبارتاند از:
- بهینهسازی جرم گلبول قرمز و درمان کمخونی پیش از عمل
- کاهش و پیشگیری از خونریزی و از دست رفتن خون
- افزایش تحمل بیمار نسبت به کمخونی و بهینهسازی اکسیژنرسانی
این سه ستون بهصورت مکمل عمل میکنند؛ یعنی اگر حتی یکی از آنها نادیده گرفته شود، کل برنامه PBM ناکامل خواهد بود.
“`
🧬 ستون اول: بهینهسازی جرم گلبول قرمز و درمان کمخونی
۱) تعریف و اهمیت
کمخونی یکی از مهمترین عوامل افزایش نیاز به انتقال است. ۳۰–۵۰٪ بیماران جراحی الکتیو هنگام پذیرش دچار درجاتی از کمخونیاند و اغلب درمان نمیشوند؛ این موضوع با افزایش عفونت، سکته قلبی، طول بستری و مرگ مرتبط است.
۲) ارزیابی و تشخیص کمخونی پیش از عمل
حداقل دو هفته پیش از جراحی: CBC، فریتین، آهن سرم، TIBC، TSAT، B12/فولات و بررسی علل مزمن (التهاب، CKD، سرطان، خونریزی مزمن). انواع شایع: IDA، ACD، مخلوط.
۳) درمان کمخونی و بهبود جرم RBC
آهن خوراکی/تزریقی: Ferric carboxymaltose/iron sucrose بر اساس وزن و Hb؛ ویتامین C جذب را بالا میبرد.
ESA در ACD/CKD/سرطان: همراه با آهن IV در دورههای ۱–۳ هفتهای. اصلاح B12/فولات: برای پاسخدهی به ESA ضروری است. تغذیه و سبک زندگی: رژیم غنی از آهن/پروتئین و اجتناب از چای/قهوه بلافاصله پس از غذا.
۴) مدیریت کمخونی اورژانسی
زمان کم تا جراحی: آهن IV با دوز بالا (مثلاً ۱ گرم FCM)، ESA دوز افزوده طی ۳–۵ روز، و آمادهسازی کنترل خونریزی و اکسیژنرسانی.
۵) نقش آزمایشگاه در ستون اول
CBC بهموقع، فریتین/B12 سریع، و شاخص CHr برای ارزیابی ذخیره آهن.
🩸 ستون دوم: کاهش و پیشگیری از خونریزی و از دست رفتن خون
۱) اهمیت
کاهش خونریزی مؤثرترین راه برای کاهش نیاز به انتقال است؛ خونریزی کنترلنشده شوک، اختلال انعقادی و MT را رقم میزند.
۲) پیش از عمل
قطع/تنظیم ضدانعقاد/ضدپلاکت، ارزیابی PT/aPTT/INR/فیبرینوژن/PLT، فونویلبراند در سابقه خونریزی، کنترل فشار/قند، پرهیز از NSAID.
۳) حین عمل
تکنیکهای کمتهاجمی، Electrocautery/Stapler، چسبهای فیبرینی، کنترل دما، TXA (۱g قبل از برش + ۱g انتهای عمل)، پرهیز از رقیقسازی با کریستالوئید زیاد، تزریق هدفمند فاکتورها با ROTEM/TEG، Cell salvage و ANH.
۴) پس از عمل
پایش محل جراحی، حفظ دما، کاهش خونگیری غیرضروری، پانسمان فشاری و استفاده از ROTEM در ICU/قلب.
۵) نقش آزمایشگاه
گزارش سریع انعقاد، الگوریتمهای تزریق مبتنی بر شواهد: فیبرینوژن <1.5 g/L → کرایو/کنسانتره؛ PLT <50k → پلاکت؛ INR >1.5 → پلاسما/PCC.
🫀 ستون سوم: افزایش تحمل بیمار نسبت به کمخونی
۱) فلسفه
هدف فقط بالا بردن Hb نیست؛ افزایش تحمل فیزیولوژیک بدن به کمخونی با بهینهسازی همودینامیک/اکسیژناسیون نیز مهم است.
۲) فاکتورهای مؤثر
وضعیت قلبی، سن، عملکرد ریوی، حجم داخل عروقی/پرفیوژن.
۳) استراتژیها
بهینهسازی فشار/حجم/CO، اکسیژنتراپی هدفمند، بهبود میکروگردش، پرهیز از هیپوترمی و اسیدوز.
۴) آستانه انتقال (Triggers)
| نوع بیمار | آستانه انتقال (Hb g/dL) | توضیح |
|---|---|---|
| غیرقلبی سالم | 7 | انتقال در Hb<7 توصیه میشود |
| قلبی/ایسکمیک | 8 | یا در حضور علائم ایسکمی |
| ICU بحرانی | 7–8 | با پایش اکسیژن/لاکتات |
| سالمندان/COPD | 8–9 | بر اساس وضعیت تنفسی |
۵) تغذیه و توانبخشی
رژیم غنی از آهن/ویتامینهای B، تحرک زودرس و فیزیوتراپی.
جمعبندی بخش سوم
سه ستون PBM چرخهای مترابط میسازند: درمان کمخونی ← کاهش خونریزی ← افزایش تحمل کمخونی. خروجی: مراقبت ایمنتر، مؤثرتر و مقرونبهصرفهتر.
🏥 بخش چهارم: استراتژیها و مراحل اجرایی پیادهسازی مدیریت خون بیمار
مقدمه
اجرای موفق PBM به سازماندهی نظاممند، همکاری چندرشتهای و تعهد مدیریتی نیاز دارد؛ همانند یک سیستم کیفیت بالینی در تمام سطوح.
پنج مرحله WHO:
1) سیاستگذاری و تعهد مدیریتی
2) ارزیابی و برنامهریزی
3) آموزش و فرهنگسازی
4) اجرا و پایش بالینی
5) بهبود مستمر و پایداری
🔹 مرحله اول: سیاستگذاری و تعهد مدیریتی
۱) تشکیل کمیته PBM
کمیته مرکزی با رئیس (هماتولوژی/انتقال خون)، نایبرئیس (بیهوشی/جراحی) و اعضا (بانک خون، ICU، کنترل عفونت، کیفیت، تغذیه، نماینده مدیریت)؛ مسئول سیاستگذاری، هماهنگی، نظارت بر KPIs و گزارش سالانه.
۲) تدوین سیاستها و پروتکلها
سیاستهای مکتوب: درمان کمخونی شرط جراحی الکتیو، محدودسازی آستانه انتقال، استفاده از آنتیفیبرینولیتیک در پرریسکها، ثبت تمام انتقالها با ذکر علت و تأیید پزشک مسئول.
۳) حمایت مدیریت ارشد
تخصیص بودجه برای تجهیزات، آموزش و نرمافزار پایش؛ موفقیت کشورهایی مثل استرالیا و آلمان به پشتوانه تصویب ملی PBM بوده است.
🔹 مرحله دوم: ارزیابی و برنامهریزی
۱) تحلیل وضعیت (Gap Analysis)
مصرف RBC/PLT/FFP، درصد کمخونهای پیشعمل، میانگین Hb پیش از تزریق، درصد انتقالهای بدون اندیکاسیون.
۲) تعیین اهداف کمی/کیفی
کاهش ۳۰٪ انتقال غیرضروری RBC در ۱۲ ماه، ۹۰٪ شناسایی/درمان کمخونی پیش از عمل، کاهش مصرف پلاسما به <0.5 واحد/بیمار.
۳) انتخاب KPIs
WHO: Hb<13 در جراحی، Hb پیشاز تزریق، میانگین واحد RBC/بیمار، Transfusion Rate، حجم خون برگشتی از Cell salvage.
🔹 مرحله سوم: آموزش و فرهنگسازی
۱) آموزش کادر درمان
تغییر نگرش به انتقال هدفمند؛ کارگاهها، آموزش تفسیر آزمایشها، مرور پروندهها.
۲) آموزش بیماران
اهمیت اصلاح کمخونی، تغذیه، پرهیز از داروهای ضدانعقادی بدون مشورت، آگاهی از خطرات انتقال غیرضروری.
🔹 مرحله چهارم: اجرا و پایش بالینی
۱) اجرای همزمان سه ستون
پروتکلهای استاندارد و مسیرهای تصمیمگیری بالینی برای هر ستون.
۲) ثبت دادهها و سیستمهای اطلاعاتی
ثبت Hb قبل از تزریق، نوع/تعداد فرآورده، اندیکاسیون و نام پزشک؛ داشبوردهای دیجیتال PBM؛ فرمهای استاندارد AABB.
۳) نقش فناوری
ROTEM/TEG، POCT Hb، Cell salvage، داشبوردهای هوشمند.
۴) الگوریتم تصمیمگیری تزریق
Hb<7: در بیعلامت → پایش؛ Hb 7–8: با ایسکمی/هیپوکسی → ۱ واحد RBC؛ Hb>8: فقط در موارد خاص. پس از هر واحد Hb مجدداً چک شود.
🔹 مرحله پنجم: بهبود مستمر و پایداری
۱) تحلیل داده و بازخورد
جلسات ماهانه کمیته PBM؛ تحلیل انتقالهای بیمورد و کمخونیهای درماننشده.
۲) ممیزی و گزارشدهی
ممیزی ششماهه داخلی/خارجی؛ بررسی تطابق با استانداردها.
۳) CQI
PBM بخشی از برنامه کیفیت بیمارستان؛ گزارش سالانه کیفیت.
۴) پایداری ملی
گنجاندن PBM در سیاست ملی، KPIs مشترک، بانک اطلاعات ملی، مشوق برای بیمارستانهای برتر.
🔹 نقش کلیدی آزمایشگاه در مدیریت خون بیمار
Hb/فریتین <6 ساعت، PT/aPTT فوری در اورژانس، حضور در جلسات کمیته، IQC/EQA مداوم.
🔹 چالشهای اجرایی مدیریت خون بیمار و راهکار ها
مقاومت فرهنگی، کمبود زمان/منابع، نبود فناوری، ضعف داده، لجستیک ESA/آهن؛ راهکار: آموزش، الگوریتمهای ساده، پایلوت محدود، همکاری با مراکز علمی.
🔹 نمونه موفق استرالیا (پرث)
شروع 2008، 6 بیمارستان؛ طی 5 سال: RBC ↓41٪، مرگومیر ↓31٪، صرفهجویی >18 میلیون دلار. کلید: تعهد مدیریت، تیم چندرشتهای، پایش آنلاین، آموزش.
جمعبندی بخش چهارم
موفقیت PBM وابسته به رهبری علمی/مدیریتی، هماهنگی چندرشتهای و پایش مستمر دادههاست؛ خروجی: ایمنی، کیفیت و صرفهجویی.
🏥 بخش پنجم: کاربردهای مدیریت خون بیمار در حوزههای بالینی مختلف
مقدمه
PBM در همه شاخهها قابل اجراست: جراحی، ICU، زنان و زایمان، بیماران مزمن، کودکان و سالمندان؛ هدف، کاهش اتلاف خون و ارتقای نتایج بدون خطر برای ایمنی است.
🩺 ۱) جراحیهای ماژور
اهمیت: بیش از ۴۰٪ انتقالها در بیماران جراحی؛ بخش زیادی قابل پیشگیری.
پیش از عمل: غربالگری/درمان کمخونی، توقف ضدانعقاد/ضدپلاکت، Hb هدف ۱۳/۱۲، آهن IV/ESA. حین عمل: کمتهاجمی، کنترل دما، TXA، Cell salvage، ROTEM/TEG. پس از عمل: کاهش خونگیری، تغذیه/تحرک زودرس، کنترل فشار/قند/دارو.
مثال: STS/SCA 2021 در جراحی قلب: میانگین RBC از ۲.۳ به ۱.۲ واحد/بیمار کاهش بدون افزایش عارضه.
💉 ۲) ICU
اهمیت: کمخونی شایع؛ TRICC نشان داد راهبرد محدودکننده (Hb هدف ۷–۸) ایمنتر/مؤثرتر است.
استراتژی: آهن IV در سپسیس، ESA در اقامت طولانی، میکروسملینگ؛ پرهیز از پلاسما/پلاکت بیمورد؛ آنتاگونیست DOACs؛ پایش لاکتات/ScvO₂؛ تهویه محافظتی.
👶 ۳) اطفال
حجم خون کمتر و اریتروپوئز نابالغ، اما تحمل نسبی به کمخونی ملایم. مداخلات: کاهش خونگیری NICU، آهن خوراکی/IV، آستانههای پایینتر با پایش دقیق، TXA با دوز وزنمحور.
👵 ۴) سالمندان
چندبیماری و داروهای ضدانعقادی شایع؛ غربالگری Hb<12، آهن IV/ESA بر حسب زمینه، کنترل ضدانعقاد، آستانه ۸–۹ در قلبی–عروقی.
🫀 ۵) قلب و جراحی قلب
PBM فعال: اصلاح کمخونی (IV Iron + ESA)، پرهیز از Hb>9 حین عمل، ROTEM، آنتیفیبرینولیتیکها. نتایج: مصرف خون ↓40٪ و مرگومیر ↓25٪.
🧫 ۶) بیماران مزمن/دیالیز
کمبود EPO، فقر آهن و التهاب: آهن IV منظم (IS/FCM)، ESA بر اساس Hb، کنترل CRP/ESR، هدف Hb ۱۰–۱۲ (بالاتر از آن خطر ترومبوز).
👩🍼 ۷) زنان و زایمان
PPH علت مهم مرگ؛ غربالگری کمخونی در T2/T3، آهن/فولات، IV Iron اگر Hb<10؛ در خونریزی فعال: TXA ۱g، مدیریت فعال مرحله سوم، آمادهسازی خون در پرخطرها؛ پس از زایمان: آهن IV و پایش Hb.
🧠 ۸) تروما و خونریزی حاد
فعالسازی فوری MTP؛ نسبت 1:1:1 (RBC:FFP:PLT) در شدیدها؛ هدف فیبرینوژن >1.5 g/L (کرایو/کنسانتره)، کنترل دما/اسید–باز، TXA در ۳ ساعت اول (CRASH-2). تمرکز: بازگرداندن هموستاز، نه فقط Hb.
🧪 ۹) سرپایی و انکولوژی
کمخونی شایع در شیمیدرمانی؛ غربالگری Hb/فریتین، ESA+IV Iron، پرهیز از انتقال مگر Hb<7–8 یا علائم ایسکمی. استفاده از micro-collection در سرپاییها.
جمعبندی بخش پنجم
PBM باید شخصیسازی شود؛ اما نتیجه مشترک در همه حوزهها: مصرف فرآوردهها ↓30–40٪، مرگومیر ↓25٪، طول بستری ↓20٪، صرفهجویی اقتصادی چشمگیر.
🧫 بخش ششم: نقش آزمایشگاه و بانک خون در مدیریت خون بیمار (PBM)
مقدمه
آزمایشگاه تشخیص طبی قلب تپنده PBM است؛ کیفیت دادهها مسیر تصمیمگیری را تعیین میکند و زیرساخت باید سریع، دقیق و مبتنی بر کنترل کیفی باشد.
۱) وظایف کلیدی آزمایشگاه
- تشخیص/طبقهبندی کمخونی: CBC، فریتین/آهن/TIBC/TSAT، B12/فولات، رتیکولوسیت و CRP.
- پایش هموستاز پیش از عمل: PT, aPTT, INR, فیبرینوژن, PLT؛ فونویلبراند و FXIII در پرخطرها.
- پایش حین عمل/ICU: POCT برای Hb/ABG/لاکتات و ROTEM/TEG.
- کنترل کیفی انتقال: ABO/Rh، غربالگری آنتیبادی، کراسمچ، ثبت مشخصات واحدها و عوارض.
- گزارشدهی و KPIs ماهانه به کمیته PBM.
۲) ارزیابی آزمایشگاهی کمخونی
CBC و شاخصها
Hb/Hct، MCV/MCH/MCHC، RDW و Retic برای تعیین نوع و علت کمخونی.
ذخایر آهن
فریتین <30: کمبود مطلق؛ 30–100 با TSAT<20٪: کمبود عملکردی؛ >300 با CRP بالا: ACD محتمل.
آزمونهای مکمل
CRP/ESR، B12/فولات، CHr (حساس برای پاسخ به آهن).
۳) آزمایشهای هموستاز
تزریق پلاسما/پلاکت/کرایو باید دادهمحور باشد. آزمونهای کلیدی: PT/INR, aPTT, فیبرینوژن, D-dimer, PLT.
ROTEM/TEG: وضعیت واقعی انعقاد/فیبرینولیز/پلاکت در <10 دقیقه؛ مزایا: کاهش 40–50٪ مصرف پلاسما/پلاکت و تصمیم سریع/هدفمند.
۴) نقش بانک خون
ایمنی/تطابق/کیفیت/ردیابی فرآوردهها؛ تغییر نقش از «تأمینکننده» به «مدیر استفاده بهینه».
وظایف
- ABO/Rh، آنتیبادیها، کراسمچ ایمن.
- پایش مصرف: C/T، TP، TI (C/T>2.5= سفارش بیشازحد؛ هدف <2).
- مدیریت ذخایر و زنجیره سرد.
- مستندسازی واکنشها: همولیتیک/آلرژیک/TRALI/TACO.
۵) کنترل کیفی
IQC: نمونههای سهسطحی، نمودار Levey–Jennings و قوانین Westgard.
EQA/PT: ارزیابی بینآزمایشگاهی. مستندسازی: ثبت و تحلیل خطاها.
۶) شاخصهای آزمایشگاهی کلیدی
| شاخص | تعریف | هدف PBM |
|---|---|---|
| Hb قبل از تزریق | میانگین Hb بیماران انتقالی | ≥7 g/dL (مطابق اندیکاسیون) |
| C/T Ratio | نسبت کراسمچ به تزریق | < 2 |
| نرخ واکنش انتقال | درصد واکنشها/کل انتقالها | < 0.5% |
| TAT CBC | نمونهگیری تا گزارش | < 2 ساعت |
| TAT PT/aPTT اورژانس | زمان گزارش | < 30 دقیقه |
۷) سیستمهای اطلاعاتی (LIS/HIS)
هشدار خودکار برای درخواست بدون Hb، گزارش آنلاین Hb پیش از تزریق، ثبت علت بالینی، داشبورد مدیریتی؛ حتی پیشنهاد هوشمند نیاز/عدم نیاز به خون.
۸) آموزش در آزمایشگاه/بانک خون
آموزش اصول PBM، تفسیر شاخصهای هماتولوژی/انعقاد، پیشگیری از خطای نمونهگیری، ایمنی انتقال و شناسایی واکنشها؛ جلسات مشترک با جراحی/ICU.
۹) ارتباط آزمایشگاه و کمیته مدیریت خون بیمار
گزارشهای منظم: Hb پایین پیشعمل، فریتین <30، انتقال با Hb>9، نتایج هموستاز در ماژورها، واکنشهای انتقال.
۱۰) نمونهٔ واقعی فرانکفورت
رد خودکار درخواست بدون Hb در LIS؛ نتیجه: RBC ↓35٪، هزینه آزمایشگاهی ↓25٪، تشخیص کمخونی پیشعمل ↑20٪.
جمعبندی بخش ششم
با داده دقیق، QC مستمر، فناوریهای جدید و ارتباط مؤثر، تصمیمهای انتقال از حدسی به شواهدمحور تغییر میکند و PBM عملی و ایمن میشود.
📊 بخش هفتم: شاخصها، نتایج و شواهد علمی در مدیریت خون بیمار (PBM)
مقدمه
PBM با قابلیت اندازهگیری دقیق عملکرد و نتایج متمایز است. WHO، SABM و AABB بر پایش منظم شاخصها تأکید دارند.
۱) شاخصهای کلیدی عملکرد (KPIs)
الف) پایهای
| شاخص | تعریف | هدف |
|---|---|---|
| Hb<13 پیش از جراحی | کمخونی پیشعمل | <20٪ |
| میانگین Hb پذیرش | وضعیت اریتروپوئز | ≥13 |
| میانگین فریتین جراحی | ذخیره آهن | ≥100 ng/mL |
ب) فرایندی
- درمان کمخونی پیش از عمل >80٪
- Hb قبل از تزریق ≤7.5 g/dL
- C/T <2
- پوشش Cell salvage >60٪ در جراحیهای پرخطر
- پوشش ROTEM/TEG >70٪ در پرخطرها
ج) نتیجهای
- کاهش درصد بیماران انتقالی ≥20٪
- میانگین واحد RBC/بیمار <1.5
- مرگومیر جراحی ↓≥25٪
- طول بستری ↓≥20٪
- عفونتهای پس از عمل ↓≥30٪
۲) شواهد علمی
الف) WHO 2023
اجرای ملی PBM در استرالیا/آلمان/اتریش/هلند: مصرف فرآوردهها ↓40٪، مرگومیر ↓28٪، تشخیص/درمان کمخونی پیشعمل ↑35٪، صرفهجویی میلیونها دلار.
ب) استرالیا (Western Australia PBM)
۶ بیمارستان، ۵ سال: RBC ↓41٪، PLT ↓27٪، FFP ↓47٪، مرگومیر ↓28٪، MI/Stroke ↓31٪، LOS ↓15٪، عفونت ↓21٪. (Leahy MF, Transfusion 2017)
ج) اروپا
آلمان: کاهش سالانه ۳۰۰هزار واحد انتقال؛ اتریش: RBC ↓35٪؛ هلند: پوشش ۸۶٪ بیمارستانها و صرفهجویی ۶۵ میلیون یورو/سال.
د) آمریکا (SABM Registry)
مصرف فرآوردهها ↓25٪، واکنش انتقالی 1.1→0.4٪، کاهش میانگین هزینه ۴۵۰ دلار/بیمار.
هـ) حوزههای خاص
| حوزه | مطالعه | نتایج |
|---|---|---|
| جراحی قلب | STS/SCA 2021 | RBC ↓40٪، مرگومیر ↓25٪ |
| ارتوپدی | SABM 2019 | مصرف خون ↓50٪ |
| ICU | TRICC/TRISS | Hb ۷–۸ ایمن/مؤثر |
| زنان و زایمان | WHO 2023 | PPH ↓ با TXA و اصلاح کمخونی |
۳) شاخصهای اقتصادی مدیریت خون بیمار
هزینه متوسط: RBC 220–300$، Plasma 150–180$، Platelet 350–450$. کاهش ۱۰۰۰ واحد انتقال = ≥250 هزار دلار صرفهجویی مستقیم + کاهش هزینههای غیرمستقیم (LOS/عوارض/دارو).
۴) ایمنی و کیفیت
کاهش TRALI تا ۵۰٪، TACO تا ۴۰٪، واکنشهای همولیتیک/تبزا تا ۷۰٪. سیستمهای الکترونیکی، خطاهای انتقال را تا ۹۰٪ کاهش دادهاند؛ کیفیت آزمایشگاهی (سرعت/دقت) نیز ارتقا مییابد.
۵) نمونه عملکرد بیمارستان وین
Hb<13 پیشعمل: 42→18٪؛ واحد RBC/بیمار: 2.1→1.0؛ مصرف پلاکت: 240→160/ماه؛ واکنش انتقال: 1.2→0.5٪؛ LOS: 7.8→6.1 روز.
۶) شاخصهای آموزشی/سازمانی
آموزش >80٪ کارکنان، جلسات بازخورد ماهانه، پایبندی به مسیرهای بالینی.
۷) رضایت بیمار
کمتر در معرض تزریق/عوارض، احساس امنیت و اعتماد به ضرورت انتقال.
۸) پایش ملی/بینالمللی
Germany PBM Network (۲۵۰ بیمارستان)، National Blood Authority – Australia، SABM Accreditation (USA)، WHO Global PBM Observatory (از 2024).
۹) چالشهای اندازهگیری
تفاوت روش جمعآوری داده، ناهماهنگی HIS/LIS، تفکیک اورژانسی/الکتیو، نیاز به تحلیل آماری. راهکار: داشبوردهای هوشمند یکپارچه.
۱۰) تحلیل نهایی
PBM شاخص بلوغ نظام سلامت و گذار به پزشکی هوشمند و مسئولانه است؛ جایی که داده، نه عادت، تصمیمساز است.
جمعبندی بخش هفتم
با پایش KPIs و آموزش مستمر، میتوان مصرف فرآوردهها را ۳۰–۵۰٪، عوارض را >۷۰٪ و مرگومیر را تا ۳۰٪ کاهش داد.
🌍 بخش هشتم: چالشها، موانع و چشمانداز آینده در مدیریت خون بیمار (PBM)
مقدمه
PBM از مرحله آزمایشی به استاندارد جهانی رسیده، اما موانعی (بهویژه در کشورهای در حال توسعه) باقی است؛ این بخش نقشهراه رفع موانع و چشمانداز آینده را ارائه میکند.
۱) چالشهای آموزشی و فرهنگی مدیریت خون بیمار
الف) نگرش سنتی
“انتقال=درمان”؛ PBM بر پیشگیری و بهینهسازی وضعیت خون پیش از نیاز تأکید دارد. راهکار: آموزش، شفافسازی علمی، بازنگری رفتارهای بالینی.
ب) آموزش ناکافی تخصصی
PBM بهصورت سیستماتیک تدریس نمیشود. راهکار: گنجاندن در کوریکولوم پزشکی/بیهوشی/هماتولوژی/علوم آزمایشگاهی، CME، مربی PBM در هر بیمارستان.
۲) چالشهای سازمانی/ساختاری
الف) نبود سیاست ملی
عدم بودجه/ساختار رسمی برای PBM. راهکار: تصویب سیاست ملی PBM، کمیته PBM در همه بیمارستانها، بودجه و پاداش عملکرد.
ب) کمیتههای غیرفعال
تمرکز بر توزیع فرآوردهها بهجای مدیریت بیمار. راهکار: شرح وظایف مشخص و گزارشدهی KPI محور.
۳) چالشهای فناورانه/اطلاعاتی
الف) فقدان یکپارچگی دیجیتال
HIS/LIS یکپارچه نیستند؛ دادههای Hb/فریتین/مصرف خون بهسختی پایش میشوند. راهکار: داشبوردهای هوشمند، اتصال مستقیم آزمایشگاه/بانک خون/کمیته PBM.
ب) کمبود فناوری نوین
ROTEM/TEG یا Cell salvage گسترده نیستند. راهکار: اولویتدهی خرید برای مراکز جراحی بزرگ، Hb Quick Test.
۴) چالشهای مالی/لجستیکی
الف) هزینه اولیه
برداشت هزینهبر بودن PBM؛ ولی در میانمدت صرفهجویی چشمگیر دارد. راهکار: مدلهای اقتصاد سلامت برای مدیران.
ب) محدودیت دسترسی به ESA/آهن IV
راهکار: تسهیلات دولتی، پوشش بیمهای درمان کمخونی پیش از جراحی.
۵) چالشهای داده/شاخص
الف) گزارشدهی غیراستاندارد
ثبت دستی و تحلیلناپذیر؛ راهکار: سامانه ملی PBM و گزارشهای سالانه.
ب) نبود مقایسه بین مراکز
راهکار: پایگاه داده مشترک، شاخصهای واحد (Hb پیشعمل، C/T، واکنش انتقالی).
۶) چالشهای بالینی مدیریت خون بیمار
الف) بیماران پرریسک
نیاز فوری به خون؛ راهکار: پروتکلهای اختصاصی اورژانسی، Auto-transfusion و Cell salvage، ابزارهای سریع Hb/هموستاز.
ب) فشار زمانی اورژانس
راهکار: تجهیز اتاق عمل و ICU به POCT/ROTEM و مسیرهای کوتاهتصمیم.
۷) چالشهای فرهنگی در ایران
وضعیت فعلی/نقاط قوت
زیرساخت بانک خون قوی، نیروی متخصص، تجربه QC فرآوردهها.
نیاز به تقویت
نبود نظام PBM مدون، آموزش ناکافی دانشگاهی، محدودیت تجهیزات پایش هموستاز.
پیشنهاد برای ایران
- کمیته ملی PBM در وزارت بهداشت
- دستورالعمل بومی بر اساس WHO/SABM
- پایلوت در بیمارستانهای آموزشی منتخب
- گسترش ۵ساله کشوری
- مرکز ملی داده PBM در سازمان انتقال خون
۸) چشمانداز جهانی مدیریت خون بیمار
WHO 2030: پوشش ۸۰٪ بیمارستانها، آموزش ۹۰٪ کارکنان، مصرف جهانی ↓40٪، رصدخانه جهانی داده PBM.
۹) فرصتهای آینده فناوری
تصمیمیارهای هوش مصنوعی، تلماتولوژی، گلبول قرمز مصنوعی/بیوپرینت، سیستمهای بسته خونگیری برای کاهش ۸۰٪ برداشت خون ICU.
۱۰) آینده PBM در ایران و منطقه
با همکاری وزارت بهداشت/دانشگاهها/سازمان انتقال خون، طی ۵ سال: مصرف فرآوردهها ↓30٪، ایمنی ↑، مرجعیت منطقهای.
۱۱) جمعبندی نهایی در مورد مدیریت خون بیمار
PBM تحولی بنیادین: پیشگیری از کمخونی مؤثرتر از تزریق؛ کنترل خونریزی ایمنتر از جبران؛ افزایش تحمل کمخونی علمیتر از درمان کورکورانه. سه دستاورد: ایمنی، نتایج بهتر، صرفهجویی اقتصادی.
منابع کلیدی برای مطالعه بیشتر در مورد مدیریت خون بیمار
- WHO (2023) – Guidance on Implementing PBM
- SABM (2021) – Standards for PBM Programs
- AABB Technical Manual (2023) – Patient Blood Management
- Leahy MF, Transfusion (2017) – Western Australia PBM
- STS/SCA (2021) – Blood Conservation in Cardiac Surgery
سوالات متداول درباره مدیریت خون بیمار (PBM)
۱) مدیریت خون بیمار چیست و چه تفاوتی با مدیریت انتقال خون دارد؟
PBM رویکردی متمرکز بر بیمار برای بهینهسازی خون و کاهش نیاز به انتقال است؛ مدیریت انتقال خون بر تأمین/توزیع فرآوردهها تمرکز داشت، PBM بر پیشگیری از نیاز.
۲) سه ستون اصلی PBM کداماند؟
۱) درمان کمخونی و بهینهسازی جرم RBC، ۲) کاهش/پیشگیری از خونریزی و اتلاف خون، ۳) افزایش تحمل کمخونی و مدیریت آستانه انتقال.
۳) آستانه انتقال خون چگونه تعیین میشود؟
بر اساس فیزیولوژی و علائم؛ راهبرد محدودکننده Hb ۷–۸ g/dL معمولاً ایمن است، ولی شرایط قلب/ریه/سن تعیینکنندهاند.
۴) نقش آزمایشگاه در PBM چیست؟
CBC/فریتین/TSAT/B12/فولات، PT/aPTT/فیبرینوژن/PLT، POCT و ROTEM/TEG؛ ایمنی انتقال، QC و گزارشدهی KPI.
۵) مهمترین مداخلات برای کاهش خونریزی حین عمل چیست؟
کمتهاجمی، کنترل دما، TXA، Cell salvage، هدایت تزریق با ROTEM/TEG، مدیریت دقیق مایعات.
۶) مزایای اقتصادی PBM چیست؟
مصرف فرآوردهها ↓30–40٪، LOS ↓، عوارض ↓؛ صرفهجویی مستقیم/غیرمستقیم قابل توجه.
۷) PBM در ICU چگونه اجرا میشود؟
راهبرد Hb محدودکننده، آهن IV/ESA انتخابی، میکروسملینگ، پایش لاکتات/ScvO₂، اکسیژنتراپی هدفمند.
۸) نقش TXA در PBM چیست؟
مهار فیبرینولیز و کاهش خونریزی در جراحیها و PPH؛ توصیهشده در موارد پرریسک.
۹) C/T Ratio یعنی چه و چرا مهم است؟
نسبت کراسمچ به تزریق؛ شاخص کارایی سفارش خون. هدف <2 برای اجتناب از سفارش اضافی.
۱۰) نخستین گامهای اجرای PBM در بیمارستان چیست؟
کمیته PBM، تحلیل وضعیت، هدفگذاری KPI، آموزش تیمها، پایلوت در چند بخش، داشبوردهای یکپارچه LIS/HIS.
