روش انجام آزمایش کومبس غیر مستقیم: راهنمای جامع برای کارشناسان آزمایشگاه
فهرست مطالب
- خلاصه مراحل کلیدی روش انجام آزمایش آزمایش کومبس غیر مستقیم
- مقدمه
- کاربردهای کلیدی
- اصل روش
- مواد و تجهیزات مورد نیاز
- روش اجرایی استاندارد (SOP)
- تفسیر و مدیریت نتایج
- خطاهای احتمالی و نکات مهم
- سؤالات رایج (FAQ)
جهت عضویت در کانال آموزشی در تلگرام به لینک زیر مراجعه کنید:
https://t.me/hematology_education
روش انجام آزمایش کومبس غیر مستقیم (روش انجام آزمایش ایندایرکت کومبس یا indirect coombs) شامل مراحل کلیدی زیر است:
آمادهسازی نمونه: جداسازی سرم یا پلاسما بیمار.
انکوباسیون: مخلوط کردن سرم بیمار با گلبولهای قرمز معرف و انکوبه کردن در دمای ۳۷ درجه سانتیگراد.
شستشو: شستشوی کامل سلولها حداقل ۳ تا ۴ بار با سالین، برای حذف آنتیبادیهای آزاد و پروتئینها.
افزودن AHG: اضافه کردن معرف آنتیگلوبولین انسانی (AHG) به نمونه شستهشده.
سانتریفیوژ و قرائت: سانتریفیوژ نمونه و بررسی آگلوتیناسیون (خوشهشدن).
کنترل کیفی: در صورت منفی بودن تست، اضافه کردن سلولهای کنترل کومبز برای تأیید صحت عملکرد معرف AHG.
این روش به تشخیص وجود آنتیبادیهای آزاد در سرم بیمار کمک میکند، که میتواند در فرآیندهایی مانند انتقال خون و بارداری خطرآفرین باشد.
مقدمه
آزمایش کومبس غیر مستقیم چیست : (Indirect Antiglobulin Test, IAT) کومبز غیر مستقیم یک روش پایه ای در ایمونوهِماتولوژی است که برای شناسایی آلو آنتیبادیها (alloantibodies) علیه آنتیژنهای گلبولهای قرمز در سرم یا پلاسمای بیمار انجام میشود. این آنتیبادیها ممکن است در اثر انتقال خون یا بارداری ایجاد شوند و در صورت عدم شناسایی، واکنشهای شدید همولیتیک را در پی داشته باشند.
کاربردهای کلیدی کومبس غیر مستقیم
- غربالگری آنتیبادی: شناسایی آنتیبادیهای نامنظم در سرم بیمار قبل از تزریق خون.
- کراسمچ: بررسی سازگاری خون اهداکننده و گیرنده.
- بررسی ناسازگاری Rh: پایش مادران Rh منفی در دوران بارداری برای پیشگیری از بیماری همولیتیک نوزادان (HDFN).
- شناسایی آنتیبادی: تعیین نوع آنتیبادی در سرم بیماران.
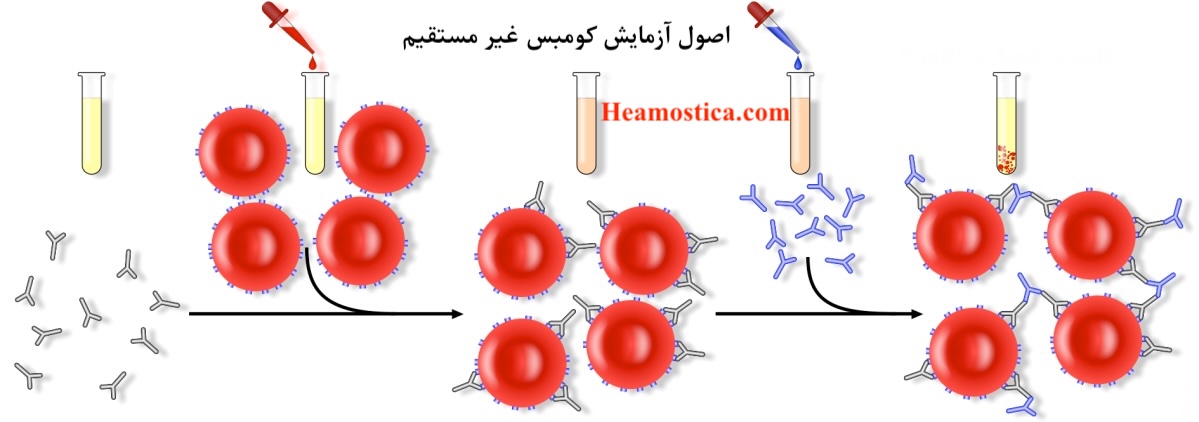
اصل روش کومبس غیر مستقیم
تست کومبز غیر مستقیم بر اساس واکنش آنتیبادی-آنتیژن در محیط آزمایشگاهی (in vitro) است. سرم بیمار با گلبولهای قرمز استاندارد (Screening/Panel Cells) که دارای آنتیژنهای شناختهشده هستند، مخلوط میشود. در صورت وجود آنتیبادیهای خاص، آنها به آنتیژنهای مربوطه روی سطح گلبولهای قرمز میچسبند. پس از شستشوی کامل گلبولها، معرف آنتیگلوبولین انسانی (AHG) اضافه میشود که با اتصال به آنتیبادیهای چسبیده، باعث آگلوتیناسیون (خوشهشدن) گلبولهای قرمز میگردد. این آگلوتیناسیون به عنوان نتیجه مثبت تفسیر میشود.
مواد و تجهیزات مورد نیاز
- نمونه: سرم یا پلاسمای تازه بیمار (ترجیحاً در عرض ۴۸ ساعت جمعآوری شده باشد).
- سلولهای معرف: سوسپانسیون ۲ تا ۵٪ گلبولهای قرمز گروه O با آنتیژنهای تأییدشده.
- معرف AHG: سرم آنتیگلوبولین انسانی (آنتی-IgG و/یا آنتی-C3d).
- سلولهای کنترل کومبز: گلبولهای قرمز حساسشده با آنتیبادی IgG انسانی.
- محلول سالین: سرم فیزیولوژی نرمال (۰.۹% NaCl) با دمای اتاق.
- تجهیزات آزمایشگاهی: لوله آزمایش، سانتریفیوژ، بن ماری ۳۷ درجه سانتیگراد، پیپتهای کالیبره، و دستگاه واشر سلولی (در صورت وجود).
روش انجام آزمایش(تست) کومبس غیر مستقیم (روش انجام ایندایرکت کومبس) :
۱. آمادهسازی نمونه:
- نمونه خون کامل را سانتریفیوژ کرده و سرم یا پلاسما را با احتیاط جدا کنید.
- نمونه نباید همولیز یا لخته باشد، زیرا بر نتایج تأثیر میگذارد.
۲. مرحله انکوباسیون:
- در یک لوله آزمایش تمیز، ۲ قطره از سرم بیمار و ۱ قطره از سوسپانسیون ۲ تا ۵٪ سلولهای معرف را بریزید.
- لوله را به آرامی مخلوط کرده و به مدت ۱۵ تا ۳۰ دقیقه در دمای ۳۷ درجه سانتیگراد (در بن ماری) انکوبه کنید.
جهت آگاهی از روش تهیه ی سوسپانسیون گلبول های قرمز به لینک زیر مراجعه کنید:
راهنمای کامل و مرحله به مرحله طرز تهیه سوسپانسیون گلبول های قرمز برای آزمایش کومبس
۳. مرحله شستشو:
- پس از انکوباسیون، لوله را سانتریفیوژ کرده و مایع رویی را به طور کامل خارج کنید.
- به لوله سالین اضافه کنید، مخلوط کرده و دوباره سانتریفیوژ کنید.
- این مرحله شستشو را ۳ تا ۴ بار تکرار کنید. شستشوی کامل برای حذف آنتیبادیهای آزاد و جلوگیری از نتایج مثبت کاذب حیاتی است.
۴. افزودن AHG:
- پس از آخرین شستشو و تخلیه کامل سالین، به رسوب سلولی ۲ قطره معرف AHG اضافه کنید.
- به آرامی مخلوط کرده و به مدت ۱۵-۲۰ ثانیه در سرعت مناسب سانتریفیوژ کنید.
۵. قرائت نتایج:
- لوله را به آرامی تکان دهید و آگلوتیناسیون را به صورت ماکروسکوپی مشاهده کنید.
- نتیجه را بر اساس شدت آگلوتیناسیون از ۰ (منفی) تا ۴+ (مثبت قوی) ثبت کنید.
۶. کنترل کیفی نهایی:
- در صورتی که نتیجه نمونه بیمار منفی باشد، برای تأیید صحت عملکرد معرف AHG، به همان لوله ۱ قطره سلول کنترل کومبز( چک سل) اضافه کنید.
- دوباره سانتریفیوژ کرده و آگلوتیناسیون را بررسی کنید. وجود آگلوتیناسیون در این مرحله الزامی است و نشان دهنده ی عملکرد صحیح AHG است. در غیر این صورت، تست نامعتبر است و باید تکرار شود.
تفسیر و مدیریت نتایج
نتیجه مثبت (+): نشاندهنده وجود آنتیبادیهای ضد گلبول قرمز در سرم بیمار است. این نتیجه نیازمند بررسی بیشتر برای شناسایی نوع آنتیبادی و ارزیابی اهمیت بالینی آن است.
نتیجه منفی (-): به معنای عدم وجود آنتیبادیهای قابل شناسایی در سرم بیمار است.
خطاهای احتمالی و نکات مهم
- شستشوی ناکافی: رایجترین علت نتایج مثبت کاذب است.
- سالین با دمای نامناسب: استفاده از سالین سرد میتواند باعث نتایج منفی کاذب شود. بهتر است از سالین با دمای اتاق یا نزدیک ۳۷°C استفاده شود.
- AHG غیرفعال یا آلوده: منجر به نتایج منفی کاذب میشود. کنترل کومبز برای شناسایی این مشکل حیاتی است.
- عدم رعایت زمان یا دمای انکوباسیون: میتواند بر حساسیت تست تأثیر بگذارد.
- کیفیت سلولهای معرف: از سلولهای معرف با کیفیت و تاریخ مصرف معتبر استفاده کنید.
با رعایت این پروتکل دقیق، میتوان از صحت و اعتبار نتایج تست کومبز غیرمستقیم اطمینان حاصل کرد.
سؤالات رایج (FAQ)
۱- تفاوت کومبس مستقیم و کومبس غیر مستقیم چیست؟
کومبز مستقیم برای شناسایی آنتیبادیهای متصل به گلبولهای قرمز در بدن بیمار استفاده میشود، در حالی که کومبز غیرمستقیم برای شناسایی آنتیبادیهای آزاد در سرم انجام میگیرد.
جهت آگاهی از روش انجام آزمایش کومبس مستقیم به لینک زیر مراجعه کنید:
روش انجام آزمایش کومبس مستقیم یا دایرکت کومبس: راهنمای جامع برای کارشناسان آزمایشگاه
همچنین در مورد مطالعه جامع در مورد کومبس مستقیم و غیر مستقیم به لینک زیر مراجعه کنید:
تفاوت کومبس مستقیم و غیر مستقیم | راهنمای جامع برای کارشناسان
۲- چه زمانی تست کومبس غیر مستقیم درخواست میشود؟
در غربالگری آنتیبادی قبل از انتقال خون، در کراسمچ، پایش مادران Rh منفی در دوران بارداری و بررسی سابقه انتقال خون یا حساسیتهای بالینی.
۳- نمونه مناسب برای تست چیست؟
سرم یا پلاسما تازه (ترجیحاً در عرض ۴۸ ساعت)؛ نمونههای همولیزه یا لختهشده نامناسب هستند.
۴- در صورت نتیجه منفی باید چه کرد؟
در صورت منفی شدن نمونه، سلول کنترل کومبس یا چک سل اضافه و مجدداً بررسی شود تا عملکرد AHG تأیید شود؛ در صورت نقص کنترل، آزمایش باید تکرار گردد.
۵- آیا این تست حساس به همه کلاسهای ایمونوگلوبولین است؟
IAT عمدتاً برای شناسایی آنتیبادیهای کلاس IgG طراحی شده است؛ بعضی از آنتیبادیهای کلاس دیگر ممکن است نیاز به روشهای تکمیلی داشته باشند.
۶- چقدر طول میکشد تا نتیجه آماده شود؟
بسته به پروتکل و تجهیزات، معمولاً بین ۳۰ تا ۶۰ دقیقه برای انجام کامل تست و قرائت نتایج زمان لازم است.
۷- آیا باید برای تعیین تیتر آنتیبادی تست دیگری انجام شود؟
بله، برای تعیین تیتر و شدت آنتیبادی لازم است آزمایشهای تکمیلی (Serial dilution / titration) انجام شود.
۸- چه آنتیبادیهایی اغلب توسط IAT شناسایی میشوند؟
عمدتاً آنتیبادیهای IgG علیه سیستمهای گروه خونی مانند Rh، Kell، Kidd، Duffy و سایر آنتیژنهای بالینی مهم.
۹- چه نکاتی برای نگهداری و کیفیت AHG مهم است؟
رعایت دمای نگهداری و تاریخ انقضا، جلوگیری از آلودگی و استفاده از آلیکوپهای یکبارمصرف برای برداشت معرف؛ همچنین کنترلهای روزانه یا سریالی برای اطمینان از فعالیت AHG ضروری است.
۱۰- چطور میتوان از مثبت کاذب جلوگیری کرد؟
با شستشوی کامل سلولها، استفاده از سالین مناسب، رعایت شرایط نگهداری AHG و استفاده از کنترلهای کیفی صحیح.