الکتروفورز هموگلوبین: راهنمای کامل برای کارشناسان علوم آزمایشگاهی
الکتروفورز هموگلوبین محیطی شامل جداسازی انواع هموگلوبین بر اساس بار الکتریکی آنها در محیطهای قلیایی و اسیدی است. این روش برای تشخیص تالاسمیها، هموگلوبینوپاتیهایی مانند هموگلوبین S، C، D، E و ارزیابی درصد HbA2 و HbF بهکار میرود و نقش مهمی در تفسیر کمخونیهای میکروسیتیک، آنمی همولیتیک و غربالگری نوزادان دارد. آشنایی دقیق با اصول الکتروفورز هموگلوبین، pH ایزوالکتریک، الگوهای مهاجرت و عوامل مؤثر بر نتیجه، برای کارشناسان آزمایشگاه ضروری است.
جهت عضویت در کانال آموزشی در تلگرام به لینک زیر مراجعه کنید:
https://t.me/hematology_education
فهرست مطالب الکتروفورز هموگلوبین
مقدمه الکتروفورز هموگلوبین
ساختار هموگلوبین و نقش آن در الکتروفورز هموگلوبین
مفهوم pH ایزوالکتریک در الکتروفورز هموگلوبین
روش کار الکتروفورز هموگلوبین در محیط قلیایی و اسیدی
تفسیر الگوها و تصویر سلولز استات و سیترات آگار
الکتروفورز هموگلوبین در بیماری سلول داسی و تصویر ژل واقعی
الگوهای الکتروفورز هموگلوبین در بیماریها
علت هممهاجرت هموگلوبینها در الکتروفورز
خطاها و نکات مهم در الکتروفورز هموگلوبین
مثالهای بالینی و تفسیر نتایج الکتروفورز هموگلوبین
جمعبندی و نکات پایانی
سوالات متداول درباره الکتروفورز هموگلوبین
منابع برای مطالعه بیشتر
مقدمه الکتروفورز هموگلوبین
الکتروفورز هموگلوبین یکی از مهمترین روشها برای بررسی ساختار و ترکیب انواع هموگلوبین در خون است. این آزمایش با استفاده از یک میدان الکتریکی، هموگلوبینهای مختلف را بر اساس بار الکتریکی، اندازه و شکل مولکولی از هم جدا میکند و امکان شناسایی اختلالات ارثی و اکتسابی هموگلوبین را فراهم میسازد.
در عمل، الکتروفورز هموگلوبین در کنار اطلاعات آزمایشهای پایهای خون مانند CBC، MCV و RDW به پزشک و کارشناس آزمایشگاه کمک میکند تا تشخیصهایی مانند تالاسمیهای آلفا و بتا، هموگلوبینوپاتیهایی مثل HbS، HbC، HbD، HbE و بسیاری از الگوهای نادر دیگر را با دقت بالاتر مطرح کند.
اهمیت بالینی این روش در مناطقی که تالاسمی و بیماری سلول داسی شیوع بالاتری دارند دوچندان است؛ زیرا تصمیمگیری درباره مشاوره ژنتیک، ازدواج، بارداری و برنامههای غربالگری نوزادان تا حد زیادی به تفسیر درست نتایج الکتروفورز هموگلوبین وابسته است. به همین دلیل، تسلط بر اصول فیزیکوشیمیایی این آزمایش، شناخت محیطهای مختلف (قلیایی و اسیدی)، آشنایی با الگوهای طبیعی و غیرطبیعی و درک محدودیتها، برای هر کارشناس علوم آزمایشگاهی ضروری است.
ساختار هموگلوبین
برای فهم رفتار هموگلوبینها در الکتروفورز، ابتدا باید ساختار مولکولی آنها را شناخت. هموگلوبین یک پروتئین چهارزیرواحدی است که از دو زنجیره آلفا و دو زنجیره غیرآلفا تشکیل شده است. زنجیرههای غیرآلفا میتوانند β، γ یا δ باشند و هرگونه جهش در ژنهای این زنجیرهها، باعث تغییر در توالی اسیدآمینه و در نتیجه تغییر بار الکتریکی و ویژگیهای فیزیکوشیمیایی هموگلوبین میشود. همین تغییرات، اساس جداسازی در الکتروفورز هموگلوبین هستند.
هموگلوبینهای طبیعی اصلی شامل HbA (α2β2)، HbA2 (α2δ2) و HbF (α2γ2) هستند. در بزرگسال سالم، HbA حدود ۹۵ تا ۹۸ درصد، HbA2 حدود ۲ تا ۳٫۵ درصد و HbF کمتر از ۱ درصد کل هموگلوبین را تشکیل میدهد. هر انحراف از این مقادیر، بهخصوص افزایش HbA2 یا HbF، میتواند نشانهای از تالاسمی یا هموگلوبینوپاتی باشد. برای تشخیص دقیق این تغییرات، علاوه بر الکتروفورز، روشهای تکمیلی مانند HPLC و کاپیلاری الکتروفورز نیز به کار میروند.
تغییرات کوچک در ساختار زنجیرهها، مانند جایگزینی یک اسیدآمینه، میتواند الگوی مهاجرت هموگلوبین را کاملاً تغییر دهد. برای مثال، در HbS تنها یک جایگزینی اسیدآمینه در موقعیت ششم زنجیره بتا رخ داده است، اما همین تغییر بظاهر کوچک باعث میشود بار مولکول نسبت به HbA تغییر کند و در محیط قلیایی کندتر حرکت نماید. در HbC نیز در همان موقعیت، یک جایگزینی اسیدآمینه دیگر اتفاق افتاده که موجب کاهش بیشتر بار منفی و مهاجرت آهستهتر هموگلوبین در میدان الکتریکی میشود. این تفاوتها، در الکتروفورز هموگلوبین به صورت باندهایی در موقعیتهای متفاوت ظاهر میشوند.
نکته مهم: برای تفسیر صحیح الکتروفورز هموگلوبین، دانستن ساختار مولکولی و درصد نسبی HbA، HbA2 و HbF در فرد سالم ضروری است. بدون این اطلاعات، تشخیص تالاسمی مینور، تالاسمی ماژور و بسیاری از هموگلوبینوپاتیها ممکن است اشتباه انجام شود.
مفهوم pH ایزوالکتریک
هر مولکول پروتئینی، از جمله هموگلوبین، دارای یک pH اختصاصی به نام pH ایزوالکتریک (pI) است؛ pHای که در آن، بار خالص مولکول صفر میشود. زمانی که محیط الکتروفورز قلیاییتر از pI باشد، هموگلوبین بار منفی میگیرد و به سمت آند (+) حرکت میکند. در مقابل، اگر محیط اسیدیتر از pI باشد، هموگلوبین بار مثبت پیدا کرده و به سمت کاتد (−) مهاجرت میکند.
تفاوت pI بین انواع مختلف هموگلوبین، تعیینکننده سرعت مهاجرت آنها در میدان الکتریکی است. هرچه فاصله pH محیط از pI مولکول بیشتر باشد، بار خالص آن نیز بیشتر شده و سرعت مهاجرت افزایش مییابد. در الکتروفورز هموگلوبین از این ویژگی استفاده میشود تا هموگلوبینهای دارای ساختار متفاوت، در موقعیتهای جداگانه روی نوار ظاهر شوند. بسیاری از هموگلوبینهای غیرطبیعی مانند HbS، HbC، HbD و HbE به دلیل تفاوت اندک در pI نسبت به HbA، الگوی مهاجرت خاص خود را نشان میدهند.
در عمل، دو محیط با pH متفاوت برای الکتروفورز مورد استفاده قرار میگیرد: محیط قلیایی (مانند سلولز استات با pH حدود ۸٫۴ تا ۸٫۶) و محیط اسیدی (مانند سیترات آگار با pH حدود ۶٫۰ تا ۶٫۲). در محیط قلیایی، تقریباً تمام هموگلوبینها دارای بار منفی هستند، اما به دلیل اختلاف pI، سرعت مهاجرت آنها متفاوت است. در محیط اسیدی، رفتار مهاجرتی کاملاً تغییر میکند و بسیاری از هموگلوبینهایی که در pH قلیایی در یک موقعیت قرار میگیرند، از هم جدا میشوند. این موضوع، اساس استفاده از ترکیب دو محیط برای تشخیص دقیق هموگلوبینوپاتیهاست.
روش کار الکتروفورز هموگلوبین در محیط قلیایی و اسیدی
برای انجام الکتروفورز هموگلوبین، معمولاً از خون کامل جمعآوریشده در لوله EDTA استفاده میشود. نمونه در صورت نگهداری در یخچال، تا چند روز برای انجام آزمایش قابل قبول است، اما ترجیح این است که در اسرع وقت مورد استفاده قرار گیرد تا از تجزیه هموگلوبین و بروز آرتیفکت جلوگیری شود. ابتدا از گلبولهای قرمز، همولیزات تهیه میشود؛ یعنی RBCها با محلولی مناسب لیز شده و هموگلوبین آزاد میشود. سپس این همولیزات روی بستر مناسب الکتروفورز قرار میگیرد.
الکتروفورز هموگلوبین روی سلولز استات در pH قلیایی
در روش سلولز استات، ابتدا نوار سلولز استات در بافر قلیایی (معمولاً بافر تریس–بورات–EDTA) قرار میگیرد تا بهطور کامل از بافر اشباع شود. سپس نوار روی پل الکتروفورز قرار گرفته و دو انتهای آن با بافر در تماس قرار میگیرند. نمونههای همولیز شده به اندازه دقیق و برابر روی نوار بارگذاری میشوند. پس از اعمال ولتاژ (مثلاً ۳۵۰ تا ۴۰۰ ولت برای مدت مشخص)، هموگلوبینها با سرعتهای مختلف به سمت آند حرکت میکنند و باندهای مجزا شکل میگیرد.
پس از پایان الکتروفورز، نوار در محلول رنگآمیزی (مانند Ponceau S) قرار میگیرد تا باندهای هموگلوبین قابل مشاهده شوند. مرحله بعد، شستشو و دیرنگ کردن است تا زمینه نوار روشن شده و باندها با وضوح کافی نمایان شوند. در نهایت، نوار خشک و نگهداری میشود. خواندن الگو باید با دقت بالا انجام شود و موقعیت و شدت باندها ثبت میگردد. در صورت امکان، استفاده از مارکر استاندارد شامل HbA، HbF، HbS و HbC به کالیبرهکردن خوانش کمک میکند.
الکتروفورز هموگلوبین روی سیترات آگار در pH اسیدی
در مواردی که الگوی الکتروفورز قلیایی، نشاندهنده هممهاجرت برخی هموگلوبینها مانند HbS، HbD و HbG باشد، انجام الکتروفورز در محیط اسیدی (سیترات آگار) ضروری است. در این روش نیز ابتدا ژل آگار حاوی بافر سیترات در pH حدود ۶ آماده میشود. نمونهها در چاهکهای ژل بارگذاری شده و جریان الکتریکی در جهت معکوس نسبت به محیط قلیایی اعمال میشود؛ یعنی در این محیط، هموگلوبینها عمدتاً به سمت قطب منفی حرکت میکنند.
در سیترات آگار، مهاجرت هموگلوبینها متفاوت از سلولز استات است و این تفاوت تا حد زیادی به pI آنها مرتبط است. بهعنوان مثال، HbS از HbD و HbG جدا میشود و هموگلوبینهای C و E نیز در موقعیتهای مختلف قرار میگیرند. پس از تکمیل الکتروفورز، ژل رنگآمیزی و شستشو میشود و الگو مانند روش قلیایی خوانده میشود.
🔬 مطالعه مقاله کامل روش انجام الکتروفورز هموگلوبین (SOP)
اگر به دنبال نسخه استاندارد و عملی SOP الکتروفورز هموگلوبین هستید،
مقاله زیر شامل تمام مراحل کار، کنترل کیفی، خطاها و نکات تخصصی است.
در بسیاری از آزمایشگاههای امروزی، علاوه بر این روشهای کلاسیک، از HPLC و کاپیلاری الکتروفورز نیز برای جداسازی و اندازهگیری دقیق درصد هر هموگلوبین استفاده میشود. با این حال، درک مفاهیم پایهای و الگوهای سلولز استات و سیترات آگار برای تفسیر درست و کنترل کیفیت نتایج همچنان اهمیت زیادی دارد. برای درک بهتر اهمیت کنترل کیفی در این آزمایشها، مطالعه مقاله
کنترل کیفی هماتولوژی
پیشنهاد میشود.
نکته: کیفیت اسمیر خون محیطی، رنگآمیزی مناسب و ارزیابی مورفولوژی گلبولهای قرمز، مکمل مهم الکتروفورز هموگلوبین است. مشاهده سلولهای تارگت، سلول داسی، آنیزوسیتوز و پوئیکیلوسیتوز میتواند تفسیر نتایج را جهتدهی کند. برای تسلط بر این بخش، مطالعه راهنمای
روش رنگآمیزی رایت گیمسا
بسیار کمککننده است.
تفسیر الگوهای الکتروفورز هموگلوبین در سلولز استات و سیترات آگار
در تصویر زیر ، نمودار مهاجرت نسبی هموگلوبینهای طبیعی و غیرطبیعی روی دو محیط مختلف نمایش داده شده است: سلولز استات در pH قلیایی و سیترات آگار در pH اسیدی. این نمودارها بهعنوان یک مرجع تصویری مهم برای کارشناسان آزمایشگاه در تفسیر الکتروفورز هموگلوبین محسوب میشوند.
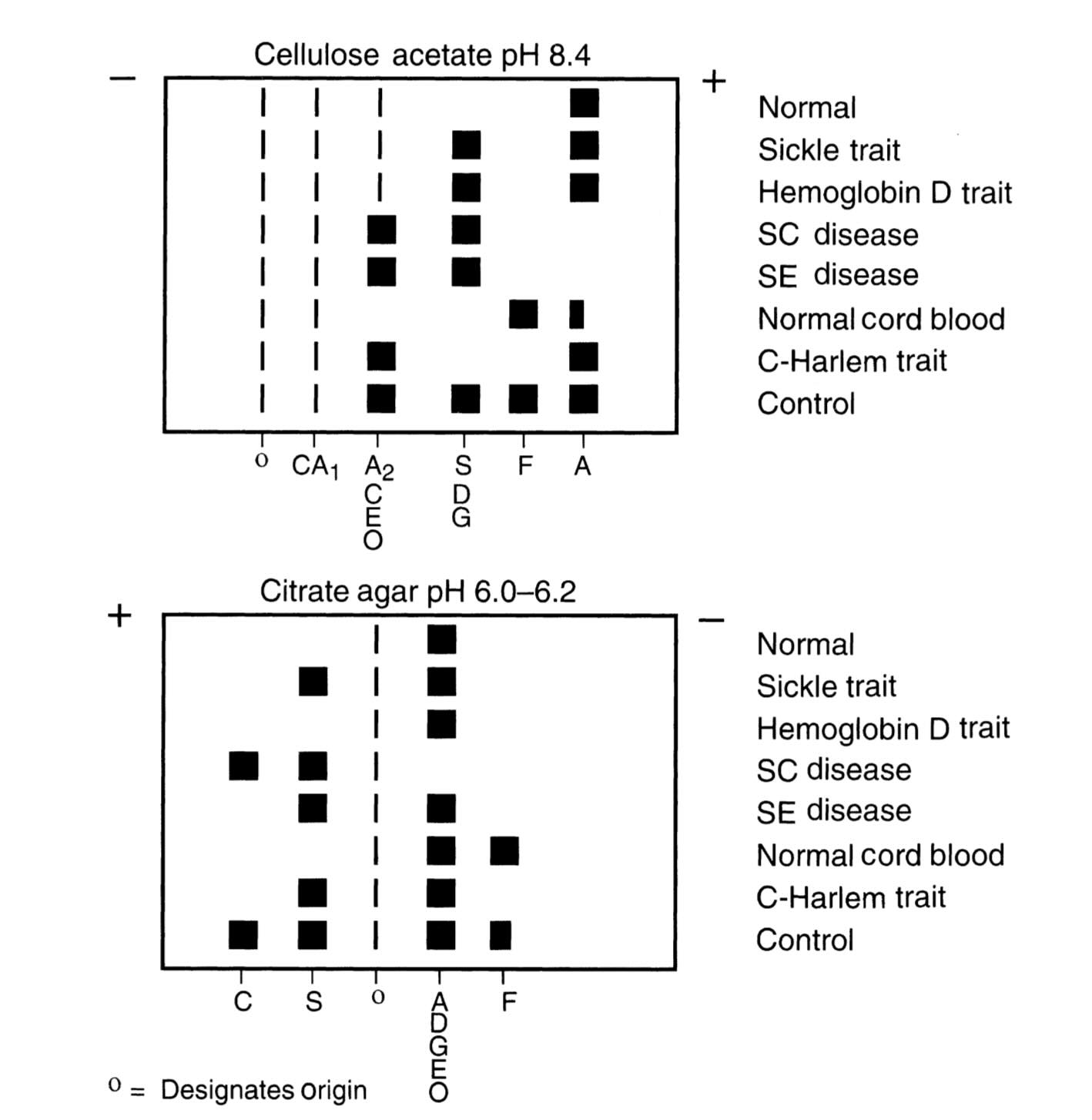
الگوی حرکتی هموگلوبین ها طی الکتروفورز هموگلوبین
در بخش بالایی تصویر، الگوهای الکتروفورز هموگلوبین روی سلولز استات در pH 8.4 نشان داده شده است. در این محیط، هموگلوبینها عمدتاً دارای بار منفی هستند و از سمت مبدأ به سمت قطب مثبت حرکت میکنند. سریعترین هموگلوبین در این محیط، HbA است که در نزدیکترین منطقه به آند قرار میگیرد. پس از آن HbF، سپس HbA2 و در نهایت گروه هممهاجرت شامل HbS، HbD و HbG دیده میشود. هموگلوبینهای C، E و O نیز در نزدیکی مبدأ باقی میمانند و مهاجرت کمتری دارند.
نکته کلیدی این است که در محیط قلیایی، برخی هموگلوبینها مانند S، D و G قابل افتراق از یکدیگر نیستند؛ زیرا در یک موقعیت روی نوار ظاهر میشوند. به همین دلیل، تنها با تکیه بر الکتروفورز قلیایی نمیتوان تشخیص قطعی برای نوع هموگلوبین ارائه کرد و در حضور باند مشکوک در ناحیه S، انجام الکتروفورز در محیط اسیدی یا روشهای تکمیلی مانند HPLC لازم است.
در بخش پایینی تصویر، الکتروفورز هموگلوبین روی سیترات آگار در pH حدود ۶٫۰ تا ۶٫۲ نمایش داده شده است. در این محیط، ترتیب مهاجرت هموگلوبینها بهطور قابل توجهی تغییر میکند. HbS از HbD و HbG جدا میشود و HbC و HbE نیز در موقعیتهای مجزا قرار میگیرند. این تفاوت، نتیجه تغییر میزان بار خالص هر هموگلوبین در pH اسیدی است و نشان میدهد که pH محیط تا چه حد میتواند الگو را دگرگون کند. استفاده همزمان از این دو محیط، یعنی قلیایی و اسیدی، یک سیستم تشخیصی مطمئن برای افتراق انواع هموگلوبین فراهم میکند.
الکتروفورز هموگلوبین در بیماری سلول داسی و تفسیر ژل واقعی
در تضویر زیر یک ژل واقعی الکتروفورز هموگلوبین در pH قلیایی را نشان میدهد که بهصورت خطوط عمودی شمارهگذاری شده است. در این تصویر، هر لاین نماینده یک نمونه است و در کنار ژل، موقعیت هموگلوبینهای A، F، S و C مشخص شده است. این نوع نمایش برای آموزش عملی الکتروفورز هموگلوبین بسیار مفید است؛ زیرا ارتباط بین الگوهای تئوری و نتایج واقعی را نشان میدهد.
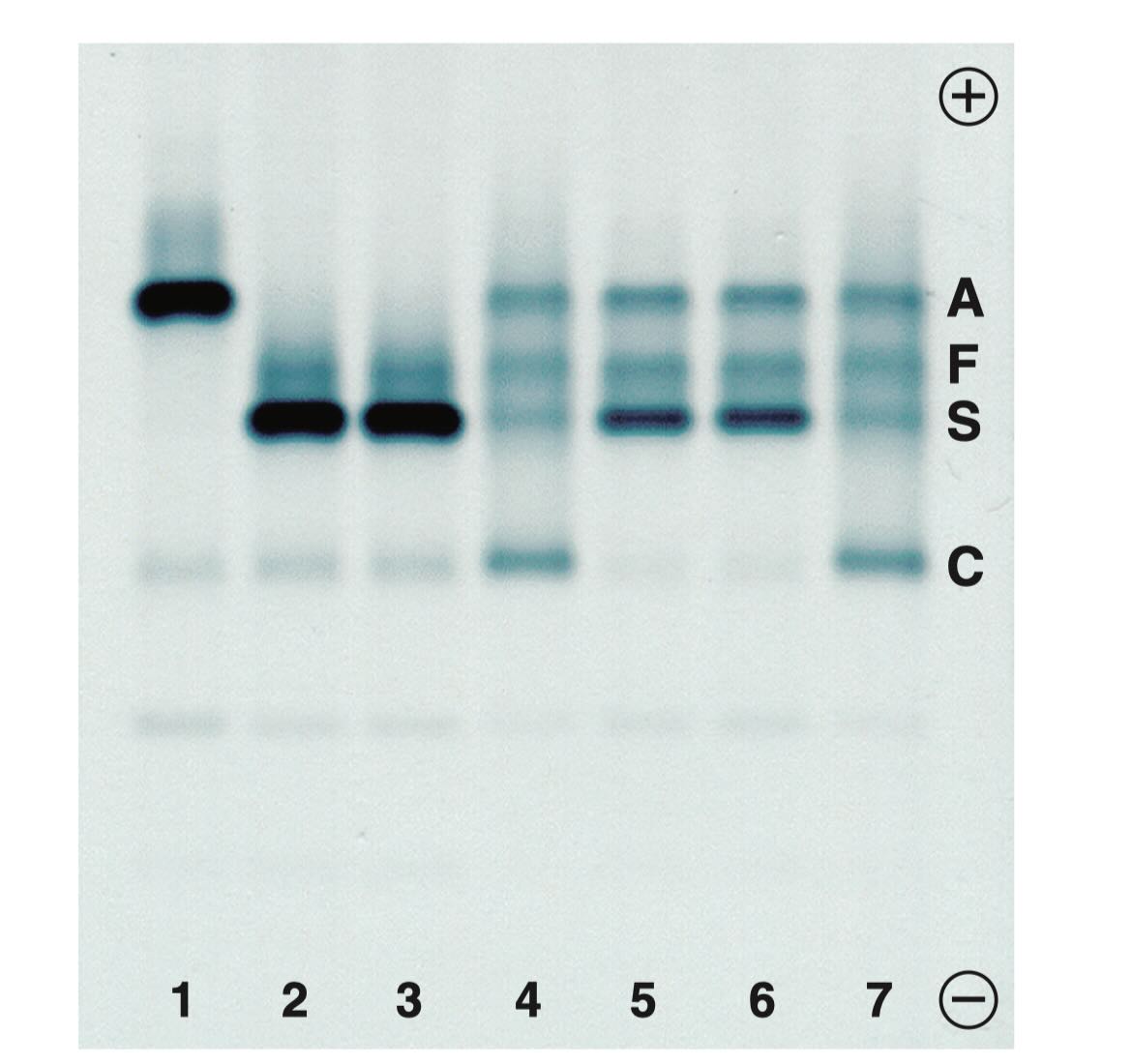
الگوی الکترفورز در حالت نرمال و بیماری داسی شکل
در لاین اول، الگوی یک فرد بالغ سالم دیده میشود. باند HbA پررنگ و واضح است و مقادیر اندکی از HbF و HbA2 نیز مشاهده میشود. در لاین دوم و سوم، نمونههای یک بیمار ۱۷ ساله مبتلا به آنمی سلول داسی (HbSS) قرار دارد. در این لاینها، باند غالب مربوط به HbS است و HbA دیده نمیشود. حضور مقدار مشخصی HbF نیز که در بیماران HbSS معمول است، بهعنوان یک یافته محافظتی نسبی شناخته میشود.
در لاین پنجم و ششم، نمونه بیمار HbSS که اخیراً ترانسفیوژن شده است دیده میشود. در این الگو، علاوه بر باند HbS، باند HbA نیز قابل مشاهده است؛ زیرا RBCهای اهداکننده حاوی HbA هستند. این مثال نشان میدهد که پس از انتقال خون، الکتروفورز هموگلوبین باید با احتیاط تفسیر شود و در صورت امکان، آزمایش پس از گذشت یک بازه زمانی مناسب و حذف RBCهای اهداکننده تکرار شود. در لاین چهارم و هفتم نیز یک استاندارد ترکیبی شامل HbA، HbF، HbS و HbC وجود دارد که برای مقایسه و کنترل کیفیت به کار میرود.
الگوهای الکتروفورز هموگلوبین در بیماریها
آشنایی با الگوهای مختلف الکتروفورز هموگلوبین در بیماریها، برای تفسیر صحیح نتایج ضروری است. در بیماری سلول داسی (HbSS)، الگو معمولاً شامل یک باند پررنگ HbS و مقادیری HbF است، در حالی که HbA وجود ندارد. در حاملین سلول داسی (HbAS)، هم HbA و هم HbS دیده میشوند و نسبت آنها معمولاً حدود ۶۰ به ۴۰ به نفع HbA است. این تفاوت در نسبتها، به کارشناس کمک میکند تا بین بیماری و حامل تفاوت قائل شود.
در بتا تالاسمی مینور، ویژگی اصلی الکتروفورز هموگلوبین افزایش HbA2 به بالای ۳٫۵ درصد است. ممکن است HbF نیز کمی افزایش یافته باشد. در بتا تالاسمی ماژور، وضعیت متفاوت است؛ در این بیماران، تولید HbA شدیداً کاهش یافته یا غایب است و HbF سهم عمده هموگلوبین را تشکیل میدهد. در آلفا تالاسمی، بهویژه در فرمهای شدیدتر، هموگلوبینهای چهارگانه مانند HbH (β4) و Hb Bart’s (γ4) ظاهر میشوند که الگوی لکهلکهای و خاص روی نوار ایجاد میکنند.
هموگلوبینهای غیرطبیعی دیگر مانند HbC، HbE و HbD نیز الگوهای خاص خود را دارند. HbC معمولاً بهصورت باندی کمتحرک نزدیک مبدأ دیده میشود و در حالت هموزیگوت، باند C غالب است، در حالیکه در حاملین، ترکیبی از HbA و HbC مشاهده میشود. HbE نیز در الکتروفورز قلیایی رفتاری شبیه HbC دارد، اما در HPLC و کاپیلاری الکتروفورز بهخوبی از آن قابل افتراق است. برای تفسیر درست این الگوها، ترکیب اطلاعات بالینی، CBC، مورفولوژی گلبول قرمز و نتایج دیگر آزمایشها بسیار مهم است. برای شناخت بهتر ارتباط میان نتایج آزمایشگاهی و بالینی، استفاده از دورههای آموزشی هماتولوژی مانند
دوره جامع آموزش تصویری هماتولوژی
میتواند بسیار مفید باشد.
علت هممهاجرت هموگلوبینها
یکی از چالشهای الکتروفورز هموگلوبین این است که برخی انواع هموگلوبین با وجود تفاوت در ساختار مولکولی، در یک موقعیت روی نوار قرار میگیرند. علت اصلی این هممهاجرت، نزدیکی pI و بار خالص آنها در pH مورد استفاده است. برای مثال، HbS، HbD و HbG در الکتروفورز قلیایی روی سلولز استات در یک ناحیه مهاجرت میکنند، زیرا بار الکتریکی آنها در این pH بسیار شبیه یکدیگر است. در چنین شرایطی، تنها با تغییر pH محیط به اسیدی (سیترات آگار) یا استفاده از روشهایی مانند HPLC میتوان آنها را از هم افتراق داد.
این هممهاجرت در تفسیر نتایج اهمیت زیادی دارد؛ زیرا اگر کارشناس تنها بر اساس الکتروفورز قلیایی حکم به وجود HbS بدهد، ممکن است در واقع HbD یا HbG حضور داشته باشد و این موضوع عواقب بالینی متفاوتی دارد. بنابراین توصیه میشود در صورت وجود هر باند غیرطبیعی یا مشکوک در ناحیه S، آزمایش تکمیلی در محیط اسیدی یا HPLC درخواست شود تا تشخیص نهایی با اطمینان بیشتری انجام شود.
خطاها و نکات مهم در الکتروفورز هموگلوبین
همانند سایر آزمایشهای هماتولوژی، الکتروفورز هموگلوبین نیز در سه مرحله پیشآنالیتیک، آنالیتیک و پسآنالیتیک در معرض خطا است. در مرحله پیشآنالیتیک، لخته بودن نمونه، همولیز شدید، نگهداری طولانیمدت، یا انجام آزمایش در فاصله کوتاهی پس از انتقال خون میتواند باعث ایجاد باندهای کاذب یا الگوهای غیرقابلتفسیر شود. در مرحله آنالیتیک، اشتباه در آمادهسازی نوار، تنظیم نادرست ولتاژ و زمان، بارگذاری بیش از حد یا بسیار کم نمونه، و بیتوجهی به دمای محیط در کیفیت نهایی الگو تأثیر میگذارد. در مرحله پسآنالیتیک، تفسیر نادرست باندها، بیتوجهی به اطلاعات بالینی و CBC و عدم مقایسه با کنترلها میتواند منجر به گزارش اشتباه شود.
استفاده از کنترلهای مناسب شامل نمونههای با الگوی طبیعی و نمونههای حاوی هموگلوبینهای غیرطبیعی شناخته شده (مانند HbS و HbC) برای اطمینان از صحت مهاجرت باندها ضروری است. علاوه بر این، مشارکت در برنامههای ارزیابی بیرونی کیفیت (EQA) به آزمایشگاه کمک میکند تا عملکرد خود را با سایر مراکز مقایسه کرده و خطاهای احتمالی را شناسایی کند. توجه به این نکات، در کنار پیادهسازی سیستم کنترل کیفی منظم که در مقاله
کنترل کیفی هماتولوژی
بهتفصیل توضیح داده شده، باعث افزایش اعتماد به نتایج الکتروفورز هموگلوبین میشود.
مثالهای بالینی و تفسیر نتایج الکتروفورز هموگلوبین
برای درک بهتر تفسیر الکتروفورز هموگلوبین، مرور چند سناریوی بالینی مفید است. در سناریوی اول، بیماری با MCV پایین، RBC بالا و RDW نسبتاً طبیعی مراجعه میکند. الکتروفورز هموگلوبین در این بیمار افزایش HbA2 به حدود ۵٫۵ تا ۶ درصد و افزایش خفیف HbF را نشان میدهد. این الگو در کنار یافتههای CBC به نفع بتا تالاسمی مینور است. در سناریوی دوم، نوزادی با زردی طولکشیده و آنمی مراجعه میکند. الکتروفورز، HbF بسیار بالا به همراه حضور Hb Bart’s را نشان میدهد که میتواند بیانگر یک فرم شدید آلفا تالاسمی باشد.
در سناریوی سوم، بیمار جوانی با دردهای استخوانی، سابقه بحرانهای دردناک و سابقه خانوادگی، مورد بررسی قرار میگیرد. در الکتروفورز هموگلوبین، دو باند A و S دیده میشود که نسبت آنها تقریباً ۶۰ درصد A و ۴۰ درصد S است. این الگو با حامل سلول داسی (HbAS یا sickle cell trait) مطابقت دارد. در سناریوی دیگر، بیمار مبتلا به HbSS که اخیراً ترانسفیوژن شده، الگوی ترکیبی HbS و HbA را نشان میدهد؛ در حالی که بدون توجه به سابقه انتقال خون، ممکن است به اشتباه حامل سلول داسی تلقی شود. این مثالها نشان میدهد که برای تفسیر صحیح الکتروفورز هموگلوبین، باید همواره اطلاعات بالینی، CBC، تاریخچه انتقال خون و نتایج دیگر آزمایشها را در کنار یکدیگر در نظر گرفت.
جمعبندی و نکات پایانی
الکتروفورز هموگلوبین یکی از مهمترین ابزارهای تشخیصی در هماتولوژی است که به کمک آن میتوان انواع هموگلوبینهای طبیعی و غیرطبیعی را شناسایی کرد و نقش کلیدی در تشخیص تالاسمیها، هموگلوبینوپاتیها و بسیاری از اختلالات ژنتیکی گلبول قرمز دارد. شناخت ساختار هموگلوبین، مفهوم pH ایزوالکتریک، تفاوت رفتار هموگلوبینها در محیطهای قلیایی و اسیدی، الگوهای مخصوص بیماریهای مختلف و عوامل مؤثر بر کیفیت الکتروفورز، برای هر کارشناس آزمایشگاه ضروری است.
ترکیب الکتروفورز هموگلوبین با سایر اطلاعات آزمایشگاهی و بالینی، از جمله CBC، بررسی اسمیر خون محیطی، تاریخچه انتقال خون و سابقه خانوادگی، امکان رسیدن به یک تشخیص دقیقتر را فراهم میکند. همچنین بهرهگیری از روشهای تکمیلی مانند HPLC و کاپیلاری الکتروفورز، دقت تشخیصی را افزایش میدهد و محدودیتهای روشهای کلاسیک را تا حد زیادی جبران میکند. توجه به کنترل کیفی، استفاده از نمونههای کنترل استاندارد و شرکت در برنامههای ارزیابی بیرونی، پایه اعتماد به نتایج الکتروفورز هموگلوبین است و باید در هر آزمایشگاه بهطور جدی اجرا شود.
سوالات متداول
۱. الکتروفورز هموگلوبین چیست و چه کاربردی دارد؟
الکتروفورز هموگلوبین روشی است که در آن هموگلوبینهای مختلف بر اساس بار الکتریکی و ویژگیهای فیزیکوشیمیایی در یک میدان الکتریکی از هم جدا میشوند. این آزمایش برای تشخیص تالاسمیها، هموگلوبینوپاتیها، ارزیابی درصد HbA2 و HbF، و بررسی علت کمخونیهای میکروسیتیک و همولیتیک استفاده میشود.
۲. چه نوع نمونهای برای الکتروفورز هموگلوبین لازم است؟
معمولاً از خون کامل جمعآوریشده در لوله EDTA استفاده میشود. نمونه باید بدون لخته، با حداقل همولیز و ترجیحاً در مدت کوتاهی پس از جمعآوری مورد آزمایش قرار گیرد. نگهداری چندروزه در یخچال امکانپذیر است، اما استفاده از نمونههای تازه باعث کاهش خطا میشود.
۳. تفاوت محیط قلیایی و اسیدی در الکتروفورز هموگلوبین چیست؟
در محیط قلیایی مانند سلولز استات، هموگلوبینها عمدتاً بار منفی دارند و به سمت آند حرکت میکنند، اما برخی از آنها مانند HbS، HbD و HbG در یک موقعیت قرار میگیرند. در محیط اسیدی مانند سیترات آگار، رفتار مهاجرتی تغییر میکند و این هموگلوبینها از هم جدا میشوند. استفاده همزمان از هر دو محیط به افتراق دقیق انواع هموگلوبین کمک میکند.
۴. pH ایزوالکتریک چه نقشی در الکتروفورز هموگلوبین دارد؟
pH ایزوالکتریک نقطهای است که در آن بار خالص هموگلوبین صفر میشود. اگر pH محیط بالاتر از pI باشد، هموگلوبین بار منفی میگیرد و اگر پایینتر باشد، بار مثبت پیدا میکند. تفاوت pI بین انواع مختلف هموگلوبین، سبب تفاوت در سرعت مهاجرت آنها در میدان الکتریکی و در نهایت جداسازی روی نوار الکتروفورز میشود.
۵. در تالاسمی مینور، الکتروفورز هموگلوبین چه الگویی نشان میدهد؟
در بتا تالاسمی مینور، الکتروفورز هموگلوبین معمولاً افزایش HbA2 به بالای ۳٫۵ درصد و در برخی موارد افزایش خفیف HbF را نشان میدهد. HbA همچنان هموگلوبین غالب است. این الگو به همراه MCV پایین و RBC نسبتاً بالا، تشخیص بتا تالاسمی مینور را تقویت میکند.
۶. تفاوت حامل سلول داسی با بیماری سلول داسی در الکتروفورز چیست؟
در بیماری سلول داسی (HbSS)، باند HbS غالب است و HbA معمولاً وجود ندارد، در حالی که در حامل سلول داسی (HbAS)، هر دو باند HbA و HbS دیده میشوند و نسبت HbA بیشتر از HbS است. علاوه بر این، در HbSS معمولاً HbF نیز تا حدی افزایش یافته است.
۷. چرا پس از انتقال خون، تفسیر الکتروفورز هموگلوبین دشوار میشود؟
پس از انتقال خون، در گردش خون بیمار مخلوطی از RBCهای خود بیمار و RBCهای اهداکننده وجود دارد که هرکدام ممکن است ترکیب هموگلوبین متفاوتی داشته باشند. بنابراین در الکتروفورز، باندهای حاصل از HbA اهداکننده و هموگلوبین غیرطبیعی بیمار روی هم دیده میشود و ممکن است الگو بهاشتباه تفسیر شود. در چنین شرایطی، بهتر است الکتروفورز با فاصله زمانی مناسب تکرار شود.
۸. چه عواملی میتوانند باعث خطا در الکتروفورز هموگلوبین شوند؟
لخته بودن یا همولیز شدید نمونه، نگهداری طولانیمدت، تنظیم نادرست ولتاژ و زمان، بارگذاری نامناسب نمونه، خشککردن بیش از حد نوار، و تفسیر نادرست الگوها همگی از عوامل ایجاد خطا هستند. استفاده از کنترلهای مناسب و رعایت اصول کنترل کیفی برای کاهش این خطاها ضروری است.
۹. نقش HPLC و کاپیلاری الکتروفورز در کنار الکتروفورز کلاسیک چیست؟
HPLC و کاپیلاری الکتروفورز روشهای خودکار و دقیقتری هستند که علاوه بر جداسازی هموگلوبینها، درصد هر جزء را بهطور کمی گزارش میکنند. این روشها بهویژه در تشخیص بتا تالاسمی مینور، اندازهگیری HbA2 و HbF و افتراق هموگلوبینهای هممهاجرت در الکتروفورز کلاسیک بسیار کمککنندهاند.
۱۰. آیا برای همه بیماران کمخونی لازم است الکتروفورز هموگلوبین انجام شود؟
خیر، انجام الکتروفورز هموگلوبین بیشتر در بیمارانی توصیه میشود که کمخونی میکروسیتیک با فریتین طبیعی یا بالا دارند، مشکوک به تالاسمی یا هموگلوبینوپاتی هستند، سابقه خانوادگی بیماریهای هموگلوبین دارند یا نتایج CBC و اسمیر خون محیطی نشاندهنده الگوهای غیرطبیعی است. انتخاب بیمار مناسب، از درخواستهای غیرضروری و تفسیرهای اشتباه جلوگیری میکند.
منابع برای مطالعه بیشتر
- McPherson RA, Pincus MR. Henry’s Clinical Diagnosis and Management by Laboratory Methods. 23rd ed. Elsevier.
- Hoffbrand AV, Higgs DR, Keeling DM, Mehta AB. Postgraduate Haematology. 7th ed. Wiley-Blackwell.
NCBI Bookshelf – Hemoglobinopathies Overview
دوره جامع آموزش تصویری هماتولوژی – فصل آزمایشهای پایهای خون و مغز استخوان
روش رنگآمیزی رایت گیمسا: آموزش کامل مراحل، نکات و کنترل کیفی
کنترل کیفی هماتولوژی در آزمایشگاه – راهنمای عملی
“`
