تیتراسیون اسید باز چیست؟ آموزش کامل تیتراسیون اسید–باز برای دانشجویان شیمی و علوم آزمایشگاهی
تیتراسیون اسید باز روشی از تجزیه حجمی است که در آن با افزودن تدریجی یک اسید یا باز استاندارد (تیترانت) به محلول حاوی اسید یا باز مجهول، غلظت آن با استفاده از واکنش خنثیسازی و روابط استوکیومتری محاسبه میشود. در این فرایند، تغییرات pH و تشخیص نقطه همارزی با کمک اندیکاتور یا دستگاه، نقش کلیدی دارد.
در این مقاله جامع، مفهوم تیتراسیون اسید باز، اصول نظری، تعاریف کلیدی مانند نقطه همارزی، نقطه پایان و خطای تیتراسیون، تحلیل منحنیهای pH، و دو مثال عملی کامل شامل تیتراسیون اسید استیک در سرکه و تعیین همزمان NaOH و Na₂CO₃ بهصورت گامبهگام توضیح داده میشود.
جهت عضویت در کانال آموزشی در تلگرام به لینک زیر مراجعه کنید:
https://t.me/hematology_education
فهرست مطالب تیتراسیون اسید باز
مقدمه جامع: تیتراسیون اسید باز چیست و چرا مهم است؟
اصول نظری تیتراسیون اسید باز و تعاریف پایه (نقطه همارزی، نقطه پایان، اندیکاتور، خطای تیتراسیون)
منحنیهای تیتراسیون اسید باز: اسید قوی، اسید ضعیف، باز ضعیف و سیستمهای چندپروتونی
مطالعه موردی اول: تیتراسیون اسید استیک در سرکه با NaOH (نمونه کلاسیک تیتراسیون اسید باز)
مطالعه موردی دوم: تعیین همزمان NaOH و Na₂CO₃ با اسید قوی (تیتراسیون چندمرحلهای)
جمعبندی تحلیلی و نکات حرفهای در تیتراسیون اسید باز
نتیجهگیری نهایی درباره تیتراسیون اسید–باز
سوالات متداول درباره تیتراسیون اسید باز (FAQ)
منابع معتبر برای مطالعه بیشتر در مورد تیتراسیون اسید–باز
مقالات مرتبط با تیتراسیون و اندیکاتورها در Heamostica
مقدمه جامع
تیتراسیون اسید باز یکی از بنیادیترین روشهای تجزیهٔ حجمی در شیمی تجزیه است که بر رفتار اسیدها و بازها در محلولهای آبی و بر پایهٔ واکنش خنثیسازی (Neutralization Reaction) استوار است. در این روش، از یک محلول استاندارد با غلظت معلوم که تیترانت (Titrant) نامیده میشود برای تعیین غلظت مادهای مجهول، که معمولاً آنالیت (Analyte) خوانده میشود، استفاده میگردد. در تیتراسیون اسید باز، یونهای هیدرونیوم (H₃O⁺) و هیدروکسید (OH⁻) با هم واکنش داده و آب تشکیل میدهند و این واکنش به دلیل کامل و سریع بودن، مبنای مناسبی برای اندازهگیری کمی فراهم میکند.
واکنش کلی خنثیسازی را میتوان به صورت زیر نوشت:
H⁺ (aq) + OH⁻ (aq) → H₂O (l)
تیتراسیون به دلیل سرعت واکنش، سادگی شیمی، قابلیت کنترل بالا و امکان محاسبهٔ دقیق بر اساس استوکیومتری واکنش، در آزمایشگاههای آموزشی، تحقیقاتی، صنعتی، دارویی، محیطی و علوم آزمایشگاهی پزشکی کاربرد گستردهای دارد. بسیاری از سنجشهای کمی در محیطهای واقعی مانند تعیین اسیدیتهٔ سرکه، قلیائیت آب، کنترل کیفیت محلولهای دارویی و تعیین ترکیب بازهای مخلوط، بر اساس همین اصول تیتراسیون اسید باز انجام میشوند.
آنچه تیتراسیون اسید باز را از سایر روشهای حجمی متمایز میکند، تغییرات قابلتوجه و نسبتاً ناگهانی pH در حوالی نقطهٔ همارزی (Equivalence Point) است. این تغییرات مبنای انتخاب اندیکاتورهای اسید–باز (Acid–Base Indicators) و روشهای ابزارمحور مانند pHمتر برای تشخیص نقطه پایان (End Point) است. بنابراین، فهم رفتار pH در طول تیتراسیون، برای تسلط بر تیتراسیون اسید باز ضروری است.
نکته مهم:
تیتراسیون اسید باز فقط یک تکنیک حجمی ساده نیست؛ بلکه روش کاملاً کمی و استوکیومتری است که دقت آن به درک صحیح از رفتار اسید و باز، انتخاب اندیکاتور مناسب، و اجرای دقیق مراحل عملی بستگی دارد.
اصول نظری تیتراسیون اسید باز و تعاریف پایه
برای فهم بهتر مطلب، لازم است مفاهیم کلیدی مانند نقطه همارزی (Equivalence Point)، نقطه پایان (End Point)، خطای تیتراسیون (Titration Error)، اندیکاتور (Indicator)، منحنی تیتراسیون (Titration Curve) و استانداردسازی (Standardization) بهصورت دقیق تعریف و تحلیل شوند. این مفاهیم چارچوب نظری تیتراسیون را تشکیل میدهند و بدون تسلط بر آنها، استفاده از تیتراسیون اسید باز به عنوان یک روش کمی دقیق امکانپذیر نیست.
نقطه همارزی (Equivalence Point)
نقطه همارزی (Equivalence Point) ، لحظهای است که تعداد مولهای تیترانت افزودهشده دقیقاً از نظر استوکیومتری با تعداد مولهای آنالیت واکنشداده برابر شده است. این نقطه یک مفهوم تئوریک است و مستقل از روش مشاهده یا اندیکاتور است. به عنوان مثال در تیتراسیون HCl با NaOH، نقطه همارزی زمانی است که تعداد مولهای HCl و NaOH برابر شوند. در تیتراسیون اسید استیک (CH₃COOH) با NaOH، نقطه همارزی وقتی است که تمام اسید استیک به یون استات (CH₃COO⁻) تبدیل شده باشد.
pH محلول در نقطهٔ همارزی لزوماً برابر ۷ نیست. pH نقطه همارزی به ماهیت اسید و باز بستگی دارد:
- در تیتراسیون اسید قوی–باز قوی (Strong Acid–Strong Base) معمولاً pH نقطهٔ همارزی نزدیک ۷ است.
- در تیتراسیون اسید ضعیف–باز قوی (Weak Acid–Strong Base)، pH نقطهٔ همارزی بزرگتر از ۷ است؛ زیرا نمک حاصل، خاصیت بازی دارد.
- در تیتراسیون اسید قوی–باز ضعیف (Strong Acid–Weak Base)، pH نقطهٔ همارزی کوچکتر از ۷ است؛ زیرا نمک حاصل، خاصیت اسیدی دارد.
نقطه پایان (End Point)
نقطه پایان (End Point) لحظهای است که آزمایشگر در عمل، پایان تیتراسیون را مشاهده میکند. در روشهای اندیکاتوری، این لحظه با تغییر رنگ اندیکاتور (Indicator) مشخص میشود. در روشهای ابزارمحور مانند تیتراسیون پتانسیومتریک یا pHمتری، نقطه پایان از تغییرات شدید در منحنی اندازهگیریشده استخراج میشود.
نقطه پایان همیشه کمی با نقطه همارزی تفاوت دارد؛ زیرا اندیکاتور در یک بازهٔ pH تغییر رنگ میدهد، نه در یک مقدار pH واحد. این اختلاف بین نقطهای که واکنش از نظر استوکیومتری کامل شده و نقطهای که ما پایان را میبینیم، منبع یکی از مهمترین خطاهای تیتراسیون اسید باز است.
خطای تیتراسیون (Titration Error) و خطای اندیکاتور
خطای تیتراسیون (Titration Error) اختلاف بین حجم تیترانت لازم برای رسیدن به نقطه همارزی تئوریک و حجم لازم برای رسیدن به نقطه پایان تجربی است. وقتی از اندیکاتور استفاده میکنیم، بخش عمدهای از این خطا ناشی از خواص اندیکاتور است و به آن خطای اندیکاتور (Indicator Error) گفته میشود. اگر اندیکاتور در بازهای از pH تغییر رنگ دهد که دقیقاً بر جهش pH منحنی تیتراسیون منطبق نیست، نقطه پایان قبل یا بعد از نقطه همارزی دیده میشود و نتیجهٔ محاسبات کمی دچار انحراف میگردد.
علاوه بر خطای اندیکاتور، خطاهای دیگری نیز در تیتراسیون اسید باز نقش دارند؛ از جمله خطای خواندن بورت، وجود حباب در نوک بورت، شستوشوی ناقص دیوارهٔ ارلن، خطای دمایی و خطای ناشی از واکنشهای جانبی (مانند جذب CO₂ توسط NaOH). مجموعهٔ این خطاها در کنار هم، دقت و صحت نهایی نتیجه را تعیین میکند.
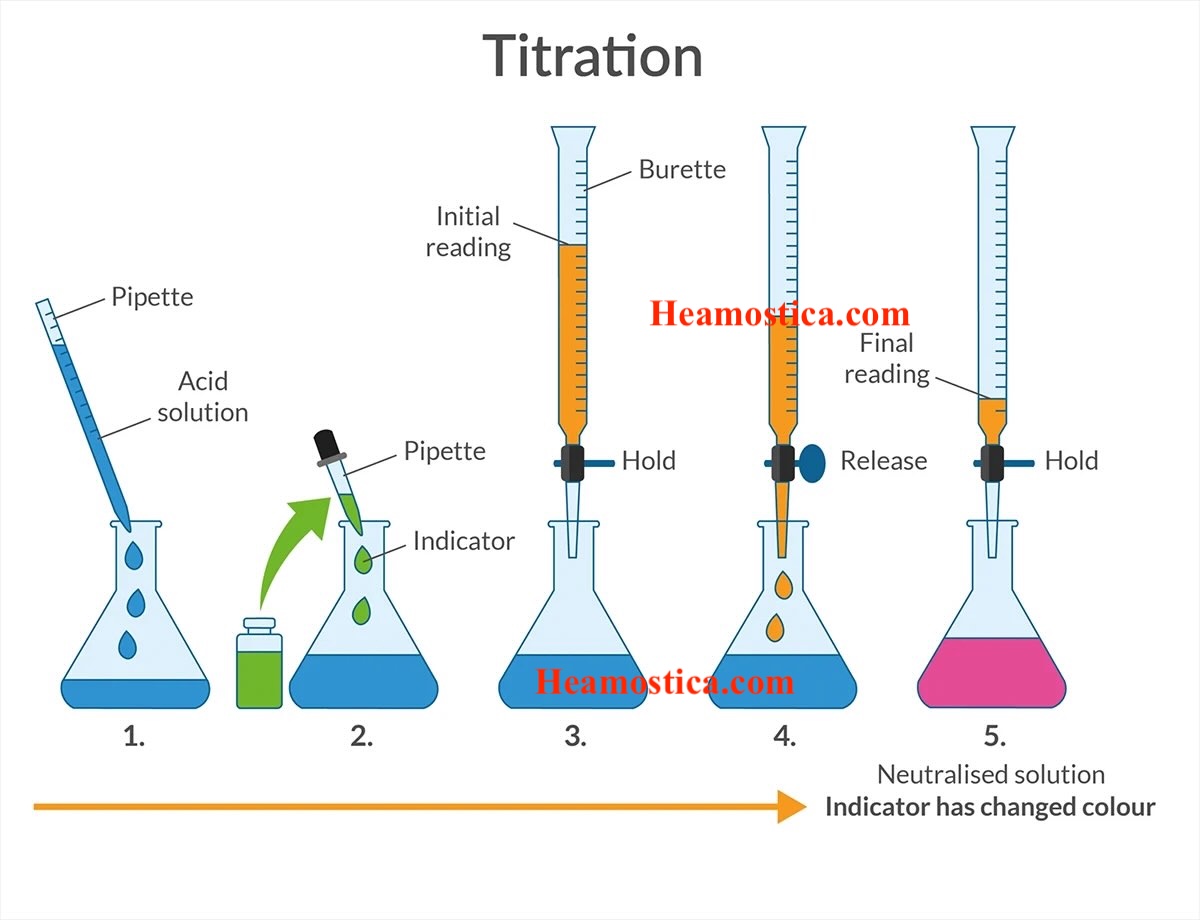
اندیکاتورهای اسید–باز (Acid–Base Indicators) در تیتراسیون اسید باز
اندیکاتورها مولکولهای آلی ضعیفاً اسیدی یا بازی هستند که دو فرم اسیدی و بازی آنها رنگهای متفاوتی دارند. تعادل بین فرم اسیدی (HIn) و فرم بازی (In⁻) اندیکاتور مطابق واکنش زیر است:
HIn ⇌ H⁺ + In⁻
نسبت [In⁻]/[HIn] تابع pH محیط است و در بازهٔ خاصی از pH تغییرات نسبت این دو فرم، سبب تغییر رنگ قابلمشاهده میشود. این بازه را محدودهٔ تغییر رنگ اندیکاتور (Transition Range) مینامند.
در تیتراسیون اسید باز، اندیکاتور مناسب اندیکاتوری است که محدودهٔ تغییر رنگ آن با ناحیهٔ جهش pH منحنی تیتراسیون در حوالی نقطه همارزی منطبق باشد. به عنوان مثال:
- فنلفتالئین (Phenolphthalein): محدودهٔ تغییر رنگ تقریباً 8.2 تا 10؛ مناسب برای تیتراسیونهای اسید ضعیف–باز قوی مانند تیتراسیون اسید استیک با NaOH.
- متیل اورنج (Methyl Orange): محدودهٔ تغییر رنگ حدود 3.1 تا 4.4؛ مناسب برای تیتراسیونهای اسید قوی–باز ضعیف یا سیستمهایی که نقطه همارزی در pH اسیدی قرار دارد.
- برمو تیمول بلو (Bromothymol Blue): محدودهٔ تغییر رنگ حدود 6.0 تا 7.6؛ مناسب برای تیتراسیونهای اسید قوی–باز قوی که نقطهٔ همارزی در حوالی pH = 7 است.
نکته مهم در انتخاب اندیکاتور تیتراسیون اسید باز:
در انتخاب اندیکاتور، نباید صرفاً نام اسید و باز را در نظر گرفت؛ بلکه باید شکل منحنی تیتراسیون و محدودهٔ جهش pH در حوالی نقطه همارزی تحلیل شود. اندیکاتور باید در بخشی از منحنی تغییر رنگ دهد که شیب منحنی بیشترین مقدار را دارد.
مطالعه بیشتر درباره اندیکاتور فنل فتالئین در تیتراسیون اسید باز:
برای آشنایی عملی با نحوهٔ تهیه و استفاده از محلول فنل فتالئین در تیتراسیون اسید باز، میتوانید مقالهٔ زیر را در سایت Heamostica مطالعه کنید:
روش تهیه محلول فنل فتالئین: راهنمای آموزشی برای کارشناسان
منحنی تیتراسیون (Titration Curve) در تیتراسیون اسید باز
منحنی تیتراسیون نموداری از pH محلول بر حسب حجم تیترانت افزودهشده است. این منحنی تصویری از رفتار اسید باز در طول تیتراسیون ارائه میدهد و از روی آن میتوان نوع سیستم (اسید قوی، اسید ضعیف، باز ضعیف، چندپروتونی)، موقعیت نقطه همارزی، محدودهٔ مناسب اندیکاتور و حساسیت روش را تحلیل کرد.
در تیتراسیون اسید قوی–باز قوی، منحنی دارای جهش شدید و تقریباً متقارن در حوالی pH = 7 است. در تیتراسیون اسید ضعیف–باز قوی، جهش pH در نقطه همارزی به سمت pHهای قلیاییتر متمایل میشود و بخش قابلتوجهی از منحنی در ناحیهٔ بافری (Buffer Region) قرار دارد. در تیتراسیون باز ضعیف–اسید قوی، پلهٔ جهش pH در ناحیهٔ pH اسیدی رخ میدهد. در سیستمهای چندپروتونی، منحنی ممکن است چندین پلهٔ مجزا داشته باشد که هر پله متناظر با خنثیسازی یک پروتون است.
استانداردسازی (Standardization) تیترانت و استاندارد اولیه (Primary Standard)
در تیتراسیون اسید باز، غلظت تیترانت باید با دقت بالا معلوم باشد. بسیاری از محلولهای اسیدی یا بازی، مانند محلول NaOH یا HCl تهیهشده در آزمایشگاه، به دلیل جذب گازها از هوا (مثل CO₂)، تبخیر، یا خطای وزنکشی نمیتوانند مستقیماً بهعنوان محلول استاندارد استفاده شوند. به همین دلیل، لازم است این محلولها با استفاده از مواد مرجع استاندارد اولیه (Primary Standards) استانداردسازی شوند.
استاندارد اولیه مادهای است که:
- خلوص بسیار بالا دارد.
- از نظر شیمیایی پایدار است.
- وزن مولی نسبتاً بزرگی دارد تا خطای وزنکشی کاهش یابد.
- در هوا رطوبتگیر یا CO₂گیر نباشد.
- در آب بهخوبی حل شود.
نمونههای متداول استاندارد اولیه برای تیتراسیون اسید باز عبارتاند از:
- KHP (پتاسیم هیدروژن فتالات) برای استانداردسازی NaOH.
- Na₂CO₃ خشک برای استانداردسازی اسیدهای قوی.
- بوراکس (Na₂B₄O₇·۱۰H₂O) برای استانداردسازی HCl.
نکته مهم در استانداردسازی تیترانت در تیتراسیون اسید باز:
بدون استانداردسازی معتبر، حتی اگر تیتراسیون با دقت حجمی بالا انجام شود، نتایج از نظر کمی قابل اعتماد نخواهد بود؛ زیرا تمام محاسبات بر پایهٔ غلظت واقعی تیترانت استوار است.
منحنیهای تیتراسیون اسید باز: اسید قوی، اسید ضعیف، باز ضعیف و سیستمهای چندپروتونی
تحلیل منحنیهای تیتراسیون اسید باز ابزار قدرتمندی برای درک رفتار سیستم و انتخاب روش مناسب است. انواع عمدهٔ منحنیها در تیتراسیون اسید باز شامل تیتراسیون اسید قوی با باز قوی، اسید ضعیف با باز قوی، باز ضعیف با اسید قوی و تیتراسیون سیستمهای چندپروتونی است. هر یک از این منحنیها ویژگیهای خاص خود را دارند و شکل منحنی مستقیماً از قدرت اسید و باز، غلظتها، و تعادلهای شیمیایی ناشی میشود.
تیتراسیون اسید قوی با باز قوی در تیتراسیون اسید باز
در تیتراسیون اسید قوی با باز قوی، مانند تیتراسیون HCl با NaOH، هر دو گونه بهطور کامل در آب تفکیک میشوند. در نتیجه، محاسبهٔ pH در تمام مراحل تیتراسیون نسبتاً ساده است و منحنی pH–V ویژگیهای مشخصی دارد:
- پیش از شروع تیتراسیون: pH محلول تنها تابع غلظت اسید قوی است و از رابطهٔ pH = –log[H⁺] به دست میآید.
- قبل از نقطه همارزی: مقدار H⁺ هنوز از OH⁻ افزودهشده بیشتر است. غلظت H⁺ از اختلاف مولی H⁺ اولیه و OH⁻ افزودهشده بر حجم کل محاسبه میشود.
- در نقطه همارزی: تعداد مولهای H⁺ و OH⁻ برابر است و تنها آب و نمک خنثی (مثلاً NaCl) باقی میماند. pH تقریباً برابر ۷ است.
- پس از نقطه همارزی: OH⁻ اضافی تعیینکنندهٔ pH است و از رابطهٔ pOH = –log[OH⁻] و pH = 14 – pOH محاسبه میشود.
منحنی بهدستآمده دارای جهش بسیار تند و تقریباً متقارن در حوالی pH = ۷ است و این ویژگی امکان استفاده از اندیکاتورهایی مانند برمو تیمول بلو را فراهم میکند.
تیتراسیون اسید ضعیف با باز قوی
در تیتراسیون اسیدهای ضعیف، مانند اسید استیک (CH₃COOH)، با باز قوی (مانند NaOH)، منحنی تیتراسیون ساختار پیچیدهتری دارد. در این حالت:
- pH اولیه بهطور قابلتوجهی بالاتر از اسید قوی با همان غلظت است؛ زیرا اسید استیک تنها بهطور جزئی تفکیک میشود.
- در بخش میانی تیتراسیون، محلول شامل مخلوطی از اسید استیک و استات است و یک بافر اسید–باز تشکیل میدهد؛ در این ناحیه، pH از معادلهٔ هندرسون–هاسلباخ پیروی میکند.
- در نقطهٔ نیمهمارزی (Half-Equivalence Point)، غلظت اسید و باز مزدوج برابر است و pH برابر pKa اسید میشود؛ این نقطه برای تعیین pKa بسیار مهم است.
- در نقطهٔ همارزی، اسید استیک کاملاً به استات تبدیل شده و محلول خاصیت بازی دارد؛ pH معمولاً در بازهٔ ۸٫۷ تا ۹٫۲ قرار میگیرد.
این رفتار باعث میشود تیتراسیون اسید ضعیف–باز قوی نماد مناسبی برای آموزش تیتراسیون اسید باز و تحلیل pH باشد و انتخاب اندیکاتور در این حالت حیاتی است؛ به عنوان مثال، فنلفتالئین مناسبترین اندیکاتور است.
تیتراسیون باز ضعیف با اسید قوی در تیتراسیون اسید باز
در تیتراسیون باز ضعیفی مانند NH₃ با اسید قوی (مثلاً HCl)، رفتار منحنی به نوعی تصویر معکوس تیتراسیون اسید ضعیف–باز قوی است:
- pH اولیه بالا است، ولی بسته به Kb باز ضعیف، کمتر از سیستم باز قوی خواهد بود.
- در بخش میانی تیتراسیون، محلول شامل باز ضعیف و اسید مزدوج آن (مثلاً NH₃/NH₄⁺) است و بهصورت محلول بافری عمل میکند.
- در نقطهٔ نیمهمارزی، pH با pKb یا pKa متناظر رابطه دارد.
- در نقطهٔ همارزی، محلول عمدتاً شامل اسید مزدوج باز ضعیف است و pH کوچکتر از ۷ خواهد بود.
در چنین سیستمهایی، اندیکاتوری که در محدودهٔ pH اسیدی تغییر رنگ میدهد (مانند متیل اورنج) برای تشخیص نقطه پایان مناسبتر است.
تیتراسیون سیستمهای چندپروتونی و چندمرحلهای
در سیستمهای چندپروتونی (مانند H₂CO₃، H₃PO₄) یا سیستمهای حاوی بازهای چندظرفیتی و مخلوط، منحنیهای تیتراسیون اسید باز ممکن است چندین پلهٔ مجزا داشته باشند؛ هر پله متناظر با خنثی شدن یک ظرفیت اسیدی یا بازی است. در چنین مواردی، چند نقطهٔ همارزی وجود دارد و برای تحلیل آنها باید هر مرحله بهصورت جداگانه بررسی شود.
نمونهٔ مهمی از این نوع تیتراسیون، تیتراسیون مخلوط NaOH و Na₂CO₃ با HCl است که در آن، یون CO₃²⁻ دارای دو ظرفیتی بازی است و در دو مرحله به HCO₃⁻ و سپس به H₂CO₃ تبدیل میشود. همین ساختار دو مرحلهای مبنای بهکارگیری دو اندیکاتور و دو نقطهٔ پایان مجزا در این تیتراسیون است.
مطالعه موردی اول: تیتراسیون اسید استیک در سرکه با NaOH
تعیین مقدار اسید استیک در سرکه با استفاده از محلول استاندارد NaOH یکی از کلاسیکترین مثالهای تیتراسیون اسید باز است. در این نمونه، اسید استیک یک اسید ضعیف و NaOH یک باز قوی است. واکنش خنثیسازی کامل و تکمرحلهای بوده و اندیکاتور مناسب (فنلفتالئین) بر اساس pH نقطه همارزی انتخاب میشود. این سیستم از نظر آموزشی بسیار ارزشمند است زیرا رفتار یک اسید ضعیف در مقابل باز قوی، تشکیل بافر در طول تیتراسیون و تغییر pH در نقطهٔ همارزی را بهخوبی نشان میدهد.
واکنش شیمیایی و رفتار اسید استیک در تیتراسیون اسید باز
واکنش اصلی تیتراسیون اسید استیک (CH₃COOH) با NaOH به صورت زیر است:
CH₃COOH + OH⁻ → CH₃COO⁻ + H₂O
در این واکنش، اسید استیک به طور کامل با یونهای هیدروکسید واکنش داده و به یون استات (CH₃COO⁻) تبدیل میشود. اگرچه این واکنش از نظر استوکیومتری کامل است، اما نمک حاصل (استات سدیم) در آب تا حدی هیدرولیز میشود:
CH₃COO⁻ + H₂O ⇌ CH₃COOH + OH⁻
این هیدرولیز نمک باعث میشود محلول در نقطهٔ همارزی خاصیت بازی داشته باشد و pH در بازهٔ تقریباً ۸٫۷ تا ۹٫۲ قرار گیرد. همین ویژگی در تیتراسیون اسید باز، انتخاب اندیکاتور مناسب را تعیین میکند.
تحلیل منحنی تیتراسیون اسید استیک با NaOH
منحنی pH–V برای تیتراسیون اسید استیک با NaOH را میتوان در چند ناحیهٔ اصلی تحلیل کرد:
- pH اولیه: چون اسید استیک اسید ضعیف است، pH اولیه از رابطهٔ تعادل اسید ضعیف محاسبه میشود:[H⁺] ≈ √(Ka × Cₐ) و در نتیجه pH در محدودهٔ حدود ۲٫۵ تا ۳٫۵ قرار میگیرد (بسته به غلظت).
- ناحیهٔ بافری: با افزودن NaOH، بخشی از اسید استیک به استات تبدیل میشود و مخلوط CH₃COOH/CH₃COO⁻ تشکیل یک بافر اسید–باز میدهد. در این ناحیه pH از معادلهٔ هندرسون–هاسلباخ پیروی میکند:pH = pKa + log([CH₃COO⁻]/[CH₃COOH])
- نقطهٔ نیمهمارزی (Half-Equivalence Point): در این نقطه [CH₃COOH] = [CH₃COO⁻] و بنابراین pH = pKa اسید استیک است. این نقطه برای تعیین pKa با دقت بالا بسیار مفید است.
- نقطهٔ همارزی: در این نقطه، اسید استیک کاملاً به استات تبدیل شده است. محلول حاوی نمک باز مزدوج است و pH آن به دلیل هیدرولیز استات بالاتر از ۷ و معمولاً در حدود ۸٫۷–۹٫۲ است.
- پس از نقطهٔ همارزی: pH تحت سلطهٔ NaOH اضافی است و از رابطهٔ pOH = –log[OH⁻] اضافی و pH = 14 – pOH محاسبه میشود.
انتخاب اندیکاتور در این تیتراسیون اسید باز
با توجه به اینکه pH نقطهٔ همارزی برای تیتراسیون اسید استیک با NaOH در محدودهٔ قلیایی (حدود ۹) قرار دارد، اندیکاتور مناسب باید در بازهٔ حدود ۸ تا ۱۰ تغییر رنگ دهد. فنلفتالئین با محدودهٔ تغییر رنگ 8.2–10.0 مناسبترین اندیکاتور است؛ زیرا تغییر رنگ آن با جهش pH منحنی تیتراسیون در حوالی نقطهٔ همارزی منطبق است.
استفاده از اندیکاتورهایی مانند متیل اورنج یا متیل رد در این تیتراسیون باعث خطای قابلتوجه میشود، زیرا این اندیکاتورها در محدودهٔ pH اسیدی تغییر رنگ میدهند و نقطه پایان را در جایی نشان میدهند که هنوز واکنش خنثیسازی به طور کامل انجام نشده است.
شرح عملی مراحل تیتراسیون اسید استیک در سرکه
اجرای تیتراسیون اسید استیک در سرکه با NaOH شامل سه مرحلهٔ اصلی است: استانداردسازی NaOH، آمادهسازی نمونهٔ سرکه و انجام تیتراسیون نمونه.
۱. استانداردسازی NaOH با KHP:
محلول NaOH به دلیل جذب CO₂ هوا و تغییر غلظت، باید با استفاده از یک استاندارد اولیه مانند KHP (پتاسیم هیدروژن فتالات) استانداردسازی شود. مقدار مشخصی KHP با دقت وزنی بالا توزین شده، در حجم مناسبی از آب حل میشود و با NaOH تیتر میگردد. نقطهٔ پایان با فنلفتالئین مشخص میشود و غلظت دقیق NaOH از استوکیومتری واکنش محاسبه میشود.
۲. آمادهسازی نمونهٔ سرکه:
برای کاهش اسیدیته و افزایش دقت حجمی، نمونهٔ سرکه معمولاً رقیق میشود. مثلاً ۱۰ میلیلیتر سرکه با پیپت حبابدار به بالن ژوژهٔ ۱۰۰ میلیلیتری منتقل شده و تا خط نشانه با آب مقطر به حجم میرسد. سپس محلول بهخوبی مخلوط میشود تا یکنواخت شود.
۳. تیتراسیون نمونه:
حجم مشخصی (مثلاً ۲۰ میلیلیتر) از محلول رقیقشدهٔ سرکه با پیپت حبابدار به ارلن منتقل میشود، ۲–۳ قطره اندیکاتور فنلفتالئین اضافه میگردد و تیتراسیون با محلول استاندارد NaOH تا ظهور رنگ صورتی کمرنگ پایدار انجام میشود. حجم NaOH مصرفشده ثبت شده و از روی آن، مقدار مول اسید استیک در نمونه محاسبه میشود.
محاسبات کمی در تیتراسیون اسید استیک
اگر غلظت NaOH استانداردشده M و حجم مصرفی آن V (بر حسب لیتر) باشد، تعداد مولهای NaOH برابر M×V است. با توجه به نسبت ۱:۱ در واکنش، مولهای اسید استیک در ارلن نیز برابر M×V خواهد بود. سپس با درنظرگرفتن ضریب رقیقسازی (مثلاً ۱۰ به ۱۰۰ میلیلیتر)، مقدار کل اسید استیک در نمونهٔ اولیهٔ سرکه محاسبه شده و میتوان درصد وزنی–حجمی (w/v%) آن را به صورت گرم اسید استیک در ۱۰۰ میلیلیتر سرکه گزارش کرد.
نکته مهم در تیتراسیون اسید استیک:
بخش عمدهٔ دقت روش به استانداردسازی صحیح NaOH، انتخاب درست اندیکاتور (فنلفتالئین)، و اجرای دقیق تکنیکهای حجمی (خواندن منیسک، حذف حباب، شستوشوی دیوارهٔ ارلن) وابسته است.
مطالعه موردی دوم: تعیین همزمان NaOH و Na₂CO₃ با اسید قوی (تیتراسیون چندمرحلهای)
تعیین همزمان سدیم هیدروکسید (NaOH) و سدیم کربنات (Na₂CO₃) در یک مخلوط با استفاده از محلول استاندارد HCl نمونهای پیشرفته از تیتراسیون اسید باز است که در آن دو باز با ظرفیتهای مختلف بهطور همزمان حضور دارند. NaOH یک باز تکظرفیتی (Monoprotic Base) و Na₂CO₃ یک باز دوظرفیتی (Diprotic Base) است. به دلیل این تفاوت، با تیتراسیون مناسب میتوان مقدار هرکدام را به صورت جداگانه محاسبه کرد.
رفتار شیمیایی NaOH و Na₂CO₃
NaOH در آب کاملاً به یونهای Na⁺ و OH⁻ تفکیک میشود:
NaOH → Na⁺ + OH⁻
اما Na₂CO₃ حاوی یون کربنات (CO₃²⁻) است که میتواند در دو مرحله پروتونگیری کند:
CO₃²⁻ + H⁺ → HCO₃⁻
HCO₃⁻ + H⁺ → H₂CO₃ → CO₂↑ + H₂O
بنابراین، هر مول Na₂CO₃ میتواند دو مول H⁺ را خنثی کند. این ویژگی اساس تیتراسیون چندمرحلهای در این سیستم است و بهکمک دو نقطهٔ پایان (یکی در pH قلیایی و دیگری در pH اسیدی) میتوان مولهای NaOH و Na₂CO₃ را تفکیک و محاسبه کرد.
برای تفکیک NaOH و Na₂CO₃ از یکدیگر در تیتراسیون با HCl، از دو اندیکاتور و دو نقطه پایان استفاده میشود:
- نقطهٔ پایان اول (Phenolphthalein End Point):
در این مرحله، تمام NaOH و نیمی از CO₃²⁻ (یعنی ظرفیت اول کربنات) با H⁺ واکنش دادهاند و CO₃²⁻ به HCO₃⁻ تبدیل شده است. pH در این نقطه در محدودهٔ قلیایی (حدود ۸٫۳) است و اندیکاتور فنلفتالئین از صورتی به بیرنگ تغییر رنگ میدهد. - نقطهٔ پایان دوم (Methyl Orange End Point):
در این مرحله، HCO₃⁻ به H₂CO₃ تبدیل شده و سپس به CO₂ و H₂O تجزیه میشود. pH در این نقطه در محدودهٔ اسیدی (حدود ۴) است و اندیکاتوری مانند متیل اورنج یا متیل رد تغییر رنگ میدهد. در این نقطه، کل ظرفیت بازی سیستم (NaOH + کل CO₃²⁻) خنثی شده است.
شرح عملی مراحل تیتراسیون NaOH و Na₂CO₃
اجرای این تیتراسیون اسید باز معمولاً شامل مراحل زیر است:
۱. استانداردسازی HCl:
محلول HCl با استفاده از استاندارد اولیهای مانند بوراکس استانداردسازی میشود. مقدار دقیقی از بوراکس توزین شده، در آب حل میشود و با HCl تیتر میگردد. نقطهٔ پایان با اندیکاتوری مانند متیل رد تعیین میشود و غلظت دقیق HCl از استوکیومتری واکنش محاسبه میشود.
۲. آمادهسازی نمونهٔ مخلوط NaOH و Na₂CO₃:
نمونهٔ مخلوط در یک بالن حجمسنجی (مثلاً ۱۰۰ میلیلیتری) موجود است. محلول تا خط نشانه به حجم رسانده شده و بهخوبی مخلوط میشود تا ترکیب آن یکنواخت باشد.
۳. تیتراسیون مرحله اول (با فنلفتالئین):
حجم مشخصی (مثلاً ۲۰ میلیلیتر) از محلول مخلوط با پیپت برداشته، به ارلن منتقل میشود. چند قطره فنلفتالئین اضافه شده و تیتراسیون با HCl استاندارد انجام میگیرد تا رنگ محلول از صورتی به بیرنگ تبدیل شود. حجم HCl مصرفی در این لحظه (V₁) ثبت میشود. این حجم متناظر با خنثیسازی تمام NaOH و تبدیل CO₃²⁻ به HCO₃⁻ است.
۴. تیتراسیون مرحله دوم (با متیل اورنج یا متیل رد):
به همان محلول در ارلن، چند قطره متیل اورنج یا متیل رد اضافه میشود و تیتراسیون با HCl ادامه مییابد تا محلول به رنگ نهایی اندیکاتور (مثلاً نارنجی–قرمز برای متیل اورنج) برسد. حجم کل HCl مصرفشده تا این نقطه (V₂) ثبت میشود. اختلاف V₂ – V₁ متناظر با خنثیسازی HCO₃⁻ به H₂CO₃ است و برای محاسبهٔ مقدار Na₂CO₃ بهکار میرود.
تحلیل استوکیومتری و محاسبات در این تیتراسیون
اگر غلظت HCl برابر M باشد و حجمها بر حسب لیتر در نظر گرفته شوند:
- از مرحلهٔ دوم:مولهای CO₃²⁻ در نمونهٔ ۲۰ میلیلیتری برابر است با:
n(CO₃²⁻) = (V₂ – V₁) × M
- از مرحلهٔ اول:مولهای OH⁻ و نصف مولهای CO₃²⁻ توسط HCl خنثی شدهاند:
n(OH⁻) + ½ n(CO₃²⁻) = V₁ × M
- با جایگذاری مقدار n(CO₃²⁻) در معادلهٔ بالا، میتوان n(OH⁻) را بهدست آورد:n(OH⁻) = V₁ × M – ½ (V₂ – V₁) × M
سپس با استفاده از وزن مولی NaOH (۴۰ g/mol) و Na₂CO₃ (۱۰۶ g/mol)، میتوان جرم هر کدام را در نمونهٔ ۲۰ میلیلیتری و سپس در حجم کل محلول (مثلاً ۱۰۰ میلیلیتر) محاسبه کرد.
نکته مهم در تیتراسیون مخلوط NaOH و Na₂CO₃:
دقت این تیتراسیون اسید باز به تشخیص صحیح هر دو نقطهٔ پایان، استفادهٔ درست از دو اندیکاتور، جلوگیری از جذب یا خروج CO₂، و اجرای دقیق تکنیکهای حجمی وابسته است.
جمعبندی تحلیلی و نکات حرفهای در تیتراسیون اسید باز
تیتراسیون اسید باز، در ظاهر یک روش سادهٔ حجمی به نظر میرسد، اما در واقع مجموعهای از مفاهیم دقیق تعادل شیمیایی، رفتار اسید و باز، انتخاب اندیکاتور، تحلیل منحنیهای pH، و تکنیکهای دقیق حجمی است. دو مثال مطرحشده، یعنی تیتراسیون اسید استیک با NaOH و تیتراسیون مخلوط NaOH و Na₂CO₃ با HCl، بخش مهمی از طیف پیچیدگی تیتراسیونهای اسید–باز را پوشش میدهند.
در تیتراسیون اسید ضعیف–باز قوی (اسید استیک–NaOH)، منحنی pH–V شامل ناحیهٔ بافری مشخص، نقطهٔ نیمهمارزی (که در آن pH = pKa است) و نقطهٔ همارزی با pH قلیایی است. این ساختار نشان میدهد که محلول در طول تیتراسیون چگونه از یک اسید ضعیف به سیستم بافری و سپس به محلولی حاوی نمک باز مزدوج تبدیل میشود.
در مقابل، تیتراسیون مخلوط NaOH و Na₂CO₃ نشان میدهد که چگونه میتوان با استفاده از دو نقطهٔ پایان و دو اندیکاتور، دو باز با ظرفیتهای مختلف را بهصورت کمی از هم تفکیک کرد. رفتار دو ظرفیتی یون CO₃²⁻ و تبدیل آن به HCO₃⁻ و سپس H₂CO₃، و نقش CO₂ حاصل، پیچیدگی بیشتری به این تیتراسیون میبخشد.
انتخاب اندیکاتور در هر دو مثال نقش حیاتی دارد. در مثال اسید استیک–NaOH، اندیکاتوری مانند فنلفتالئین که در محدودهٔ قلیایی تغییر رنگ میدهد، برای تشخیص نقطهٔ همارزی مناسب است. در مثال NaOH و Na₂CO₃، اندیکاتور فنلفتالئین برای نقطهٔ پایان اول (نقطهٔ تبدیل CO₃²⁻ به HCO₃⁻) و متیل اورنج یا متیل رد برای نقطهٔ پایان دوم (تبدیل HCO₃⁻ به H₂CO₃) استفاده میشود.
تحلیل دقیق تعادلهای شیمیایی، ثابتهای تفکیک و رفتار بافری، کلید فهم علمی تیتراسیون اسید باز است. pKa و pKb تعیینکنندهٔ موقعیت نواحی بافری در منحنی و pH نقطهٔ همارزی هستند. پایداری اندیکاتورها، محدودۀ تغییر رنگ آنها و انطباق آن با منحنی pH–V، بهطور مستقیم بر خطای تیتراسیون اثر میگذارند.
در سطح عملی، مهمترین منابع خطا شامل خطای اندیکاتور، خطای حجمی (خواندن منیسک، وجود حباب، نشتی شیر بورت)، خطای دمایی، و خطاهای ناشی از واکنشهای جانبی (مانند جذب CO₂ توسط NaOH و خروج CO₂ از محلولهای حاوی H₂CO₃) است. کاهش این خطاها مستلزم رعایت دقیق اصول کار با شیشهآلات حجمی، استانداردسازی صحیح تیترانت، توجه به دمای محلول و انتخاب اندیکاتور مناسب است.
نتیجهگیری نهایی درباره تیتراسیون اسید–باز
تیتراسیون اسید باز یکی از اساسیترین و در عین حال قدرتمندترین روشهای تجزیهٔ حجمی در شیمی و علوم آزمایشگاهی است. این روش بر پایهٔ واکنش خنثیسازی و تعادلهای اسید–باز استوار است و با استفاده از منحنیهای pH، اندیکاتورهای مناسب و استانداردسازی دقیق تیترانت، امکان تعیین غلظت انواع اسیدها و بازها، چه بهصورت منفرد و چه در مخلوط، فراهم میشود.
دو مثال بررسیشده، ابعاد مختلف تیتراسیون اسید باز را نشان دادند:
تیتراسیون اسید استیک با NaOH، نمونهای از تیتراسیون اسید ضعیف–باز قوی با ناحیهٔ بافری مشخص و نقطهٔ همارزی قلیایی است. تیتراسیون مخلوط NaOH و Na₂CO₃ با HCl، نمونهای از تیتراسیون چندمرحلهای با دو نقطهٔ پایان مجزا است که در آن با استفاده از دو اندیکاتور مناسب، میتوان دو باز با رفتار شیمیایی متفاوت را بهطور کمی تفکیک کرد.
تسلط بر مفاهیم پایه شامل نقطهٔ همارزی، نقطهٔ پایان، خطای تیتراسیون، انتخاب اندیکاتور، تحلیل منحنیهای pH، و استانداردسازی تیترانت—شرط لازم برای استفادهٔ حرفهای از این روش در آزمایشگاههای آموزشی، تحقیقاتی، صنعتی، دارویی و محیطی است. با درک عمیق این اصول،این تکنیک از یک تکنیک سادهٔ حجمی به ابزاری دقیق برای تحلیل کمی و کنترل کیفیت تبدیل میشود.
سوالات متداول درباره تیتراسیون اسید باز (FAQ)
۱. تیتراسیون اسید باز چیست و چه کاربردی دارد؟
تیتراسیون اسید باز روشی از تجزیه حجمی است که در آن با افزودن تدریجی یک اسید یا باز استاندارد به محلول حاوی اسید یا باز مجهول، غلظت آن با استفاده از واکنش خنثیسازی و روابط استوکیومتری محاسبه میشود. این روش در آزمایشگاههای شیمی، علوم آزمایشگاهی، داروسازی، صنایع غذایی، آب و فاضلاب و محیطزیست برای تعیین اسیدیته، قلیائیت، غلظت یونها و کنترل کیفیت محلولها کاربرد گستردهای دارد.
۲. تفاوت نقطه همارزی (Equivalence Point) و نقطه پایان (End Point) چیست؟
نقطه همارزی لحظهای تئوریک است که در آن تعداد مولهای تیترانت افزودهشده از نظر استوکیومتری برابر با تعداد مولهای آنالیت واکنشداده است؛ اما نقطه پایان لحظهای است که آزمایشگر، پایان تیتراسیون را (معمولاً با تغییر رنگ اندیکاتور) مشاهده میکند. اختلاف بین این دو، منبع خطای تیتراسیون (بهویژه خطای اندیکاتور) است.
۳. چرا در تیتراسیون اسید استیک با NaOH، pH نقطه همارزی برابر ۷ نیست؟
اسید استیک یک اسید ضعیف است و نمک حاصل از واکنش آن با NaOH (یعنی استات سدیم) خاصیت بازی دارد؛ زیرا یون استات (CH₃COO⁻) در آب هیدرولیز شده و OH⁻ تولید میکند. به همین دلیل، محلول در نقطهٔ همارزی خاصیت قلیایی دارد و pH معمولاً در محدودهٔ ۸٫۷ تا ۹٫۲ است، نه ۷.
۴. اندیکاتور مناسب برای تیتراسیون اسید ضعیف–باز قوی در تیتراسیون اسید باز کدام است؟
در تیتراسیونهایی مانند اسید استیک با NaOH، نقطهٔ همارزی در ناحیهٔ قلیایی رخ میدهد، بنابراین اندیکاتوری مناسب است که در محدودهٔ pH حدود ۸ تا ۱۰ تغییر رنگ دهد. فنلفتالئین (Phenolphthalein) با محدودهٔ تغییر رنگ 8.2–10.0 انتخاب ایدهآل برای این نوع تیتراسیون اسید باز است.
۵. چرا استانداردسازی تیترانتضروری است؟
بسیاری از محلولهای اسیدی و بازی (مانند NaOH و HCl) به دلیل جذب CO₂، تبخیر یا خطا در تهیه، غلظت دقیق و ثابت ندارند. از آنجا که تمام محاسبات تیتراسیون اسید باز بر پایهٔ غلظت واقعی تیترانت است، لازم است تیترانت با استفاده از استانداردهای اولیه (Primary Standards) مانند KHP، Na₂CO₃ خشک یا بوراکس استانداردسازی شود تا نتایج کمی قابل اعتماد باشند.
۶. در تیتراسیون مخلوط NaOH و Na₂CO₃ با HCl، چرا از دو اندیکاتور استفاده میشود؟
چون Na₂CO₃ باز دوظرفیتی است و در دو مرحله (CO₃²⁻ → HCO₃⁻ و HCO₃⁻ → H₂CO₃) خنثی میشود، دو نقطهٔ پایان با pHهای مختلف وجود دارد. در مرحلهٔ اول، pH در ناحیهٔ قلیایی است (مناسب برای فنلفتالئین)، و در مرحلهٔ دوم، pH در ناحیهٔ اسیدی است (مناسب برای متیل اورنج یا متیل رد). استفاده از دو اندیکاتور امکان تشخیص هر دو نقطهٔ پایان و تفکیک کمی NaOH و Na₂CO₃ را فراهم میکند.
۷. مهمترین منابع خطا در این آزمایش کدامند؟
مهمترین منابع خطا شامل خطای اندیکاتور (عدم انطباق کامل نقطه پایان با نقطه همارزی)، خطای حجمی (خواندن نادرست منیسک، وجود حباب در بورت، نشتی شیر بورت)، خطای دمایی (تغییر ثابتهای تعادل با دما)، و خطاهای ناشی از واکنشهای جانبی مانند جذب CO₂ توسط NaOH یا خروج CO₂ از محلولهای حاوی H₂CO₃ است. رعایت اصول صحیح کار آزمایشگاهی این خطاها را کاهش میدهد.
۸. نقش معادلهٔ هندرسون–هاسلباخ در تیتراسیون اسید باز چیست؟
معادلهٔ هندرسون–هاسلباخ در محلولهای بافری (مثلاً در تیتراسیون اسید ضعیف–باز قوی) بهکار میرود و رابطهٔ بین pH، pKa و نسبت غلظت باز مزدوج به اسید را بیان میکند:
pH = pKa + log([A⁻]/[HA]). این رابطه برای تحلیل بخش بافری منحنی تیتراسیون و تعیین pKa از دادههای تجربی بسیار مفید است.
۹. چرا در تیتراسیون اسید باز، CO₂ میتواند منبع خطا باشد؟
CO₂ موجود در هوا میتواند توسط محلول NaOH جذب شده و آن را به Na₂CO₃ تبدیل کند، در نتیجه غلظت واقعی OH⁻ کاهش مییابد و بدون استانداردسازی، نتایج اشتباه میشوند. همچنین در محلولهای حاوی H₂CO₃، خروج CO₂ بهصورت گاز تعادل را تغییر داده و میتواند روی pH و نقطهٔ پایان اثر بگذارد. بنابراین، تماس طولانیمدت محلول با هوا باید محدود شود.
۱۰. تیتراسیون اسید باز در علوم آزمایشگاهی پزشکی چه کاربردی دارد؟
در علوم آزمایشگاهی پزشکی،برای تعیین قلیائیت آب، استانداردسازی محلولهای بافر، تنظیم pH محیطهای کشت، کنترل کیفیت محلولهای مورد استفاده در کیتهای تشخیصی و در برخی روشهای سرولوژی کاربرد دارد. اگرچه بسیاری از سنجشها امروزه با روشهای دستگاهی انجام میشود، اما این روش همچنان در تهیهٔ محلولهای مرجع و کنترل کیفیت نقشی کلیدی دارد.
منابع معتبر
تیتراسیون چیست؟ آموزش کامل تیتراسیون برای دانشجویان شیمی و علوم آزمایشگاهی – Heamostica
روش تهیه محلول فنل فتالئین: راهنمای آموزشی برای کارشناسان – Heamostica
LibreTexts – Acid–Base Titrations and Titration Curves
American Chemical Society – Resources on Acid–Base Chemistry and Titrations
Royal Society of Chemistry – Educational Materials on Acid–Base Titration
بخش مقالات آموزشی – Heamostica (دسته مقالات)
