پیوند سلولهای بنیادی و ملاحظات ایمونوهماتولوژی: آزمایشهای پیش و پس از پیوند با تمرکز بر سازگاری و عوارض ایمنی
ملاحظات ایمونوهماتولوژی در پیوند سلول های بنیادی شامل ارزیابی سازگاری گروههای خونی ABO و Rh، آنتیژنهای HLA، شناسایی آنتیبادیهای ایمنی مانند alloantibodies و autoantibodies، و مدیریت عوارض مانند همولیز ایمنی، سندرم لنفوسیت مسافر (PLS)، آپلازی خالص سلولهای قرمز (PRCA)، و بیماری پیوند علیه میزبان (GVHD) هستند. این ملاحظات برای انتخاب اهداکننده مناسب، پردازش graft، حمایت ترانسفوزیون و نظارت بر engraftment ضروری بوده و آزمایشهای پیش از پیوند (مانند antibody screening و HLA typing) و پس از پیوند (مانند chimerism analysis و isohemagglutinin monitoring) نقش کلیدی در کاهش ریسکها و بهبود نتایج درمانی HSCT ایفا میکنند.
جهت عضویت در کانال آموزشی در تلگرام به لینک زیر مراجعه کنید:
https://t.me/hematology_education
فهرست مطالب ملاحظات ایمونوهماتولوژی در پیوند سلول های بنیادی
- مقدمه: اهمیت ملاحظات ایمونوهماتولوژی در پیوند سلول های بنیادی
- سلولهای بنیادی و انواع پیوند: بررسی سازگاری در پیوند سلول های بنیادی هماتوپوئتیک
- ملاحظات ایمونوهماتولوژی در HSCT: ناسازگاری ABO و HLA در پیوند سلول های بنیادی
- آزمایشهای پیش از پیوند: ارزیابی سازگاری و ریسک در ملاحظات ایمونوهماتولوژی پیوند سلول های بنیادی
- آزمایشهای پس از پیوند: نظارت بر engraftment و عوارض در پیوند سلول های بنیادی
- حمایت ترانسفوزیون در HSCT: مدیریت محصولات خونی در ملاحظات ایمونوهماتولوژی
- عوارض و مدیریت: کنترل همولیز و GVHD در پیوند سلول های بنیادی
- نتیجهگیری: پیشرفتها در ملاحظات ایمونوهماتولوژی پیوند سلول های بنیادی
مقدمه: اهمیت ملاحظات ایمونوهماتولوژی در پیوند سلول های بنیادی
پیوند سلولهای بنیادی هماتوپوئتیک (Hematopoietic Stem Cell Transplantation – HSCT) یکی از پیشرفتهترین روشهای درمانی برای طیف وسیعی از بیماریها، از جمله سرطانهای خونی مانند لوسمی حاد میلوئیدی (AML) و لوسمی لنفوسیتی حاد (ALL)، اختلالات ایمنی مادرزادی (Primary Immunodeficiencies – PIDs)، سندرمهای نارسایی مغز استخوان ارثی (Inherited Bone Marrow Failure Syndromes – IBMFS) مانند آنمی فانکونی و آپلازی مغز استخوان، و بیماریهای خودایمنی شدید مانند مولتیپل اسکلروزیس است. این روش شامل جمعآوری سلولهای بنیادی هماتوپوئتیک (HSCs) از منابع مختلفی مانند مغز استخوان، خون محیطی پس از تحریک با فاکتورهای رشد (مانند G-CSF)، یا خون بند ناف، و سپس تزریق آنها به بیمار پس از شرطیسازی (conditioning) با شیمیدرمانی یا پرتودرمانی برای حذف سلولهای آسیبدیده است. هدف اصلی، بازسازی سیستم هماتوپوئتیک و ایمنی بیمار است، که میتواند منجر به درمان کامل (cure) در بسیاری از موارد شود.
با این حال، موفقیت HSCT به شدت وابسته به ملاحظات ایمونوهماتولوژی است، که شامل ارزیابی سازگاری گروههای خونی ABO و Rh، آنتیژنهای لکوسیتی انسانی (Human Leukocyte Antigens – HLA)، شناسایی آنتیبادیهای ایمنی (مانند alloantibodies و autoantibodies)، و مدیریت عوارض ایمنی مانند رد پیوند (graft rejection)، همولیز ایمنی (immune hemolysis)، سندرم لنفوسیت مسافر (Passenger Lymphocyte Syndrome – PLS)، آپلازی خالص سلولهای قرمز (Pure Red Cell Aplasia – PRCA)، و بیماری پیوند علیه میزبان (Graft-versus-Host Disease – GVHD) میشود. این ملاحظات نه تنها در انتخاب اهداکننده نقش دارند، بلکه در پردازش graft (مانند کاهش پلاسما یا حذف گلبولهای قرمز)، حمایت ترانسفوزیون، و نظارت طولانیمدت پس از پیوند نیز حیاتی هستند.
بر اساس مطالعات اخیر، ناسازگاری ABO در حدود ۳۰-۵۰٪ از پیوندهای allogeneic رخ میدهد و میتواند منجر به همولیز حاد یا تاخیری در ۱۰-۱۵٪ موارد شود، که اغلب نیاز به مداخلات مانند پلاسما اکسچنج دارد. علاوه بر این، در بیماران با PIDs، ارزیابیهای ایمونوهماتولوژی پیش از پیوند میتواند ریسک alloimmunization (تشکیل آنتیبادی علیه آنتیژنهای خارجی) را تا ۲۰-۳۰٪ کاهش دهد، به ویژه در افرادی که تاریخچه ترانسفوزیون مکرر دارند. همچنین، در IBMFS، آزمایشهای پیش و پس از پیوند برای شناسایی جهشهای ژنتیکی و نظارت بر engraftment (جایگزینی سلولهای اهداکننده) ضروری است، زیرا این بیماران ریسک بالایی برای شکست graft یا سرطانهای ثانویه دارند. این مقاله به بررسی جامع این ملاحظات میپردازد، با تمرکز بر آزمایشهای پیش و پس از پیوند، و ادغام پیشرفتهای اخیر مانند genotyping پیشرفته و درمانهای ایمونومدولاتوری.
سلولهای بنیادی و انواع پیوند: بررسی سازگاری در پیوند سلول های بنیادی هماتوپوئتیک
سلولهای بنیادی هماتوپوئتیک (HSCs) سلولهای چندتوانی (multipotent) هستند که در مغز استخوان ساکن بوده و قابلیت خودتجدیدی (self-renewal) و تمایز به انواع سلولهای خونی را دارند: گلبولهای قرمز (erythrocytes) برای حمل اکسیژن، گلبولهای سفید (leukocytes) برای دفاع ایمنی، و پلاکتها (thrombocytes) برای انعقاد خون. این سلولها با مارکرهایی مانند CD34+ و CD133+ شناسایی میشوند و میتوانند از طریق سیگنالینگ مسیرهایی مانند Wnt و Notch تنظیم شوند.
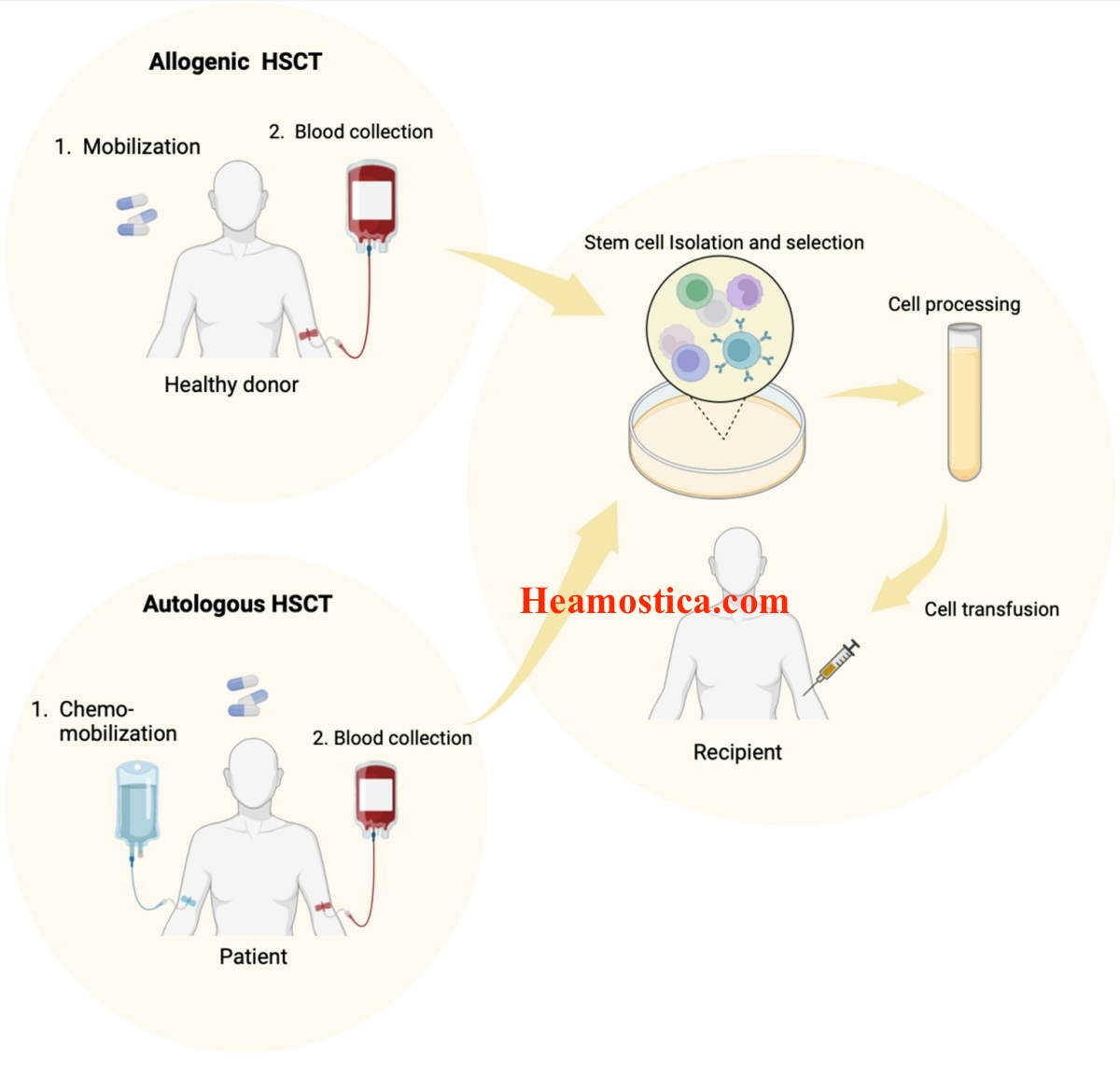
انواع پیوند HSCT بر اساس منبع و رابطه اهداکننده-گیرنده طبقهبندی میشوند:
– Autologous HSCT: سلولها از خود بیمار جمعآوری، فریز و پس از شرطیسازی شدید (high-dose chemotherapy) بازگردانده میشوند. این روش برای لنفومهای غیرهوچکین، مولتیپل میلوما، و برخی سرطانهای جامد استفاده میشود. ریسک رد پیوند کم است، اما ملاحظات ایمونوهماتولوژی عمدتاً به تاریخچه ترانسفوزیون بیمار محدود میشود، مانند شناسایی alloantibodies ناشی از ترانسفوزیونهای قبلی. عوارض اصلی شامل relapse بیماری زمینهای است، زیرا graft حاوی سلولهای سرطانی احتمالی است.
– Allogeneic HSCT: سلولها از اهداکننده دیگری گرفته میشود، که میتواند خویشاوند (related) یا غیرخویشاوند (unrelated) باشد. این روش برای بیماریهای بدخیم و غیربدخیم مانند تالاسمی ماژور و بیماری سلول داسیشکل ایدهآل است، زیرا اثر Graft-versus-Tumor (GVT) میتواند سلولهای سرطانی باقیمانده را حذف کند. زیرانواع عبارتند از:
– Matched Related Donor (MRD): سازگاری کامل HLA (۱۰/۱۰ یا ۸/۸).
– Matched Unrelated Donor (MUD): از طریق رجیستریهای جهانی مانند NMDP.
– Haploidentical: نیمهسازگار (معمولاً والدین یا فرزندان)، که با روشهایی مانند posttransplant cyclophosphamide (PTCy) برای کاهش GVHD مدیریت میشود.
– Umbilical Cord Blood (UCB): منبع غنی از HSCs با ریسک GVHD کمتر، اما engraftment کندتر (میانه ۲۵-۳۰ روز برای نوتروفیلها).
در allogeneic HSCT، ملاحظات ایمونوهماتولوژی حیاتی است زیرا ناسازگاری HLA میتواند منجر به GVHD حاد (در ۳۰-۵۰٪ موارد) یا مزمن (۴۰-۶۰٪) شود، که نیاز به پروفیلاکسی با داروهایی مانند tacrolimus یا sirolimus دارد. همچنین، در بیماران با IBMFS، پیوند haploidentical با PTCy موفقیت ۸۰-۹۰٪ دارد، اما نیاز به نظارت دقیق بر chimerism دارد.
ملاحظات ایمونوهماتولوژی در HSCT: ناسازگاری ABO و HLA در پیوند سلول های بنیادی
ایمونوهماتولوژی بر مطالعه آنتیبادیها، آنتیژنها و واکنشهای ایمنی مرتبط با خون تمرکز دارد. در HSCT، ناسازگاریهای اصلی میتوانند منجر به عوارض کشنده شوند، بنابراین ارزیابی جامع ضروری است.
– ناسازگاری ABO: آنتیژنهای ABO گلیکوپروتئینهایی روی سطح RBC هستند که توسط ژنهای ABO کد میشوند. ناسازگاری به سه نوع تقسیم میشود:
– Major Incompatibility: آنتیبادیهای گیرنده علیه آنتیژنهای اهداکننده (e.g., گیرنده O با اهداکننده A). ریسک همولیز حاد بالا (تا ۲۰٪)، نیاز به RBC depletion از graft.
– Minor Incompatibility: آنتیبادیهای اهداکننده علیه گیرنده (e.g., اهداکننده O با گیرنده A). منجر به PLS در ۱۰-۲۰٪ موارد، با همولیز تاخیری (روز ۷-۱۴).
– Bidirectional: ترکیبی، ریسک بالاتر PRCA (تا ۳۰٪ در برخی مطالعات).
– ناسازگاری Rh و سایر آنتیژنهای RBC: RhD یکی از مهمترینهاست (ژن RHD)، که در زنان باردار ریسک alloimmunization دارد. سایر سیستمها مانند Kell (KEL ژن)، Kidd (SLC14A1)، Duffy (ACKR1) میتوانند منجر به hemolytic disease شوند. در HSCT، این ناسازگاریها کمتر شایع (۵-۱۰٪) اما میتوانند engraftment RBC را تاخیر دهند.
– سازگاری HLA: HLA کلاس I (A, B, C) و کلاس II (DR, DQ, DP) برای جلوگیری از GVHD و رد. Donor-Specific Antibodies (DSA) علیه HLA میتواند engraftment را مختل کند (ریسک ۲-۵ برابر). ارزیابی با Luminex assay ضروری است.
– سایر عوامل ایمنی و عفونی: وضعیت CMV، EBV، و HBV برای جلوگیری از reactivation. تاریخچه ترانسفوزیون برای alloimmunization (تا ۵۰٪ در بیماران تالاسمی). داروهایی مانند daratumumab (anti-CD38) یا bortezomib میتوانند در آزمایشها تداخل ایجاد کنند، نیاز به wash RBC یا استفاده از dithiothreitol (DTT).
پردازش graft شامل plasma reduction (برای minor incompatibility)، RBC depletion (برای major، اگر حجم RBC >۲۰-۳۰ mL/kg)، و T-cell depletion (برای کاهش GVHD) است. در بیماران با PIDs، ارزیابی ژنتیکی برای جهشهای SCID یا CGD ضروری است تا ریسک عوارض پس از پیوند کاهش یابد.
آزمایشهای پیش از پیوند: ارزیابی سازگاری و ریسک در ملاحظات ایمونوهماتولوژی پیوند سلول های بنیادی
آزمایشهای پیش از پیوند برای ارزیابی ریسک، انتخاب اهداکننده و برنامهریزی شرطیسازی انجام میشود. این فرآیند معمولاً ۴-۶ هفته قبل شروع میشود و شامل ارزیابیهای چندرشتهای است:
– تایپینگ ABO و Rh: برای بیمار، اهداکننده و خانواده. تعیین نوع ناسازگاری و نیاز به پردازش. در major، titer anti-A/B >۱:۲۵۶ نیاز به plasma exchange پیش از پیوند دارد.
– HLA Typing و DSA Screening: تایپینگ high-resolution با NGS برای تطابق. DSA با mean fluorescence intensity (MFI) >۱۰۰۰ ریسک بالا؛ مدیریت با rituximab یا plasmapheresis.
– Antibody Screening و Identification:
– Direct Antiglobulin Test (DAT): برای آنتیبادیهای متصل به RBC (positive در AIHA).
– Indirect Antiglobulin Test (IAT): برای آنتیبادیهای circulating علیه panel RBC.
– Elution و Adsorption: برای specificity (e.g., anti-Kell).
– Isohemagglutinin Titer: برای anti-A/B (روش tube یا gel column؛ titer >۱:۶۴ ریسک همولیز).
– Extended RBC Phenotyping/Genotyping: با flow cytometry یا PCR برای آنتیژنهای RhCE, K, Jk, Fy. در بیماران SCD، genotyping برای جلوگیری از alloimmunization (ریسک ۲۰-۴۰٪) ضروری است.
– آزمایشهای عفونی و ایمنی: CMV IgG/IgM، EBV PCR، cryoagglutinins (برای همولیز سرد)، hemolysins، و ارزیابی عملکرد ارگانها (e.g., LFT برای GVHD کبدی).
– ارزیابی ژنتیکی: در IBMFS، NGS برای جهشهای FANCA, BRCA2. در PIDs، whole exome sequencing برای شناسایی زیرنوعها.
این آزمایشها کمک به انتخاب محصولات ترانسفوزیون سازگار میکنند، مانند RBC گروه O در major incompatibility.
آزمایشهای پس از پیوند: نظارت بر engraftment و عوارض در پیوند سلول های بنیادی
پس از پیوند، نظارت برای engraftment، عوارض و بازسازی ایمنی ضروری است. آزمایشها روزانه تا روز ۳۰، سپس هفتگی تا روز ۱۰۰، و ماهانه تا سال اول انجام میشود:
– ABO Typing و Isohemagglutinin Monitoring: تایپینگ forward/reverse برای تشخیص conversion به نوع اهداکننده (میانه ۶۰-۹۰ روز در major، طولانیتر در PRCA). کاهش titer >۵۰٪ نشان engraftment است.
– Antibody Screening: DAT/IAT/elution هفتگی برای همولیز (positive در ۵-۱۰٪). نظارت DSA برای platelet refractoriness (ریسک ۱۵-۲۵٪).
– Chimerism Analysis: با STR-PCR یا NGS برای درصد سلولهای اهداکننده در lineages مختلف (e.g., myeloid >۹۵٪ برای full chimerism). engraftment نوتروفیل (ANC >۵۰۰/μL) در روز ۱۴-۲۱، پلاکت (>۲۰,۰۰۰/μL) در روز ۲۰-۳۰، RBC independence در روز ۳۰-۶۰.
– تشخیص عوارض ایمنی:
– Hemolysis: LDH >۵۰۰ U/L، bilirubin >۲ mg/dL، haptoglobin <۳۰ mg/dL، urine free hemoglobin.
– PRCA: Reticulocyte <۰.۵٪، bone marrow biopsy نشاندهنده فقدان erythroid precursors (ریسک ۱۰-۲۰٪ در major ABO mismatch).
– PLS: DAT positive با anti-recipient antibodies، همولیز در روز ۵-۱۵.
– AIHA: Autoantibodies در ۳-۵٪، مدیریت با steroids یا IVIG.
– سایر آزمایشها: Corrected Count Increment (CCI) برای پلاکت (>۷۵۰۰/μL/m² پس از ترانسفوزیون)، HLA antibody monitoring، و viral PCR (CMV weekly تا روز ۱۰۰).
در بازماندگان طولانیمدت، screening برای سرطانهای ثانویه (e.g., پوست، تیروئید) و اختلالات قلبی-ریوی ضروری است.
حمایت ترانسفوزیون در HSCT: مدیریت محصولات خونی در ملاحظات ایمونوهماتولوژی
حمایت ترانسفوزیون برای مدیریت cytopenias ضروری است و بر اساس guidelines AABB و EBMT انجام میشود:
– RBC Transfusion: آستانه Hb <۷-۸ g/dL (بالاتر در symptomatic). در ABO mismatch، سازگار با هر دو نوع (e.g., O برای major).
– Platelet Transfusion: پروفیلاکتیک <۱۰,۰۰۰/μL، درمانی <۵۰,۰۰۰/μL در خونریزی. HLA-matched در refractoriness (CCI <۵۰۰۰).
– Granulocyte Transfusion: برای عفونتهای fungal/bacterial در neutropenia شدید (<۲۰۰/μL >۷ روز).
– پردازش ویژه: Irradiation (۲۵ Gy) برای TA-GVHD prevention (ریسک ۱:۱۰۰۰ در immunocompromised)، leukoreduction (کاهش WBC <۵×۱۰^۶/unit برای HLA sensitization)، CMV-safe (negative یا leukoreduced).
جدول حمایت ترانسفوزیون در ABO mismatch:
| نوع ناسازگاری | RBC پیش-engraftment | RBC پس-engraftment | Plasma/Platelet |
|---|---|---|---|
| Major | گروه O | گروه اهداکننده | گروه AB |
| Minor | گروه بیمار | گروه بیمار | گروه اهداکننده |
| Bidirectional | گروه O | گروه اهداکننده | گروه AB |
عوارض و مدیریت: کنترل همولیز و GVHD در پیوند سلول های بنیادی
عوارض ایمونوهماتولوژی میتواند engraftment را تاخیر دهد یا منجر به مرگ شود:
– همولیز ABO: مدیریت با plasma exchange، rituximab (برای B-cells)، erythropoietin برای PRCA.
– همولیز غیر-ABO: Antigen-negative units، IVIG، splenectomy در موارد مقاوم.
– GVHD: پروفیلاکسی با methotrexate + calcineurin inhibitor. درمان حاد با steroids (response ۵۰-۷۰٪)، مزمن با ruxolitinib.
– شکست Graft: ریسک ۵-۱۰٪، مدیریت با second HSCT یا DLI (Donor Lymphocyte Infusion).
– عوارض طولانیمدت: Osteoporosis، infertility، secondary malignancies (ریسک ۲-۵ برابر).
مطالعات نشان میدهد ABO mismatch بر overall survival تأثیر ندارد اما RBC transfusion را ۲-۳ برابر افزایش میدهد. در cellular therapy مانند CAR-T، ملاحظات مشابه اما با تمرکز بر cytokine release syndrome وجود دارد.
نتیجهگیری: پیشرفتها در ملاحظات ایمونوهماتولوژی پیوند سلول های بنیادی
ملاحظات ایمونوهماتولوژی در HSCT پایه موفقیت درمانی است. آزمایشهای پیش از پیوند سازگاری را تضمین میکنند، در حالی که نظارت پس از پیوند عوارض را زود تشخیص و مدیریت میکند. پیشرفتهایی مانند NGS برای HLA، درمانهای هدفمند (e.g., belimumab برای alloantibodies)، و پروتکلهای reduced-intensity conditioning چشمانداز را بهبود بخشیدهاند. با این حال، نیاز به تحقیقات بیشتر برای کاهش ریسک در گروههای خاص مانند سالمندان یا بیماران با comorbidities وجود دارد. همکاری بین هماتولوژیستها، ایمونولوژیستها و ترانسفوزیونیستها کلیدی برای نتایج بهینه است.
سوالات رایج در مورد ملاحظات ایمونوهماتولوژی پیوند سلول های بنیادی
۱. پیوند سلولهای بنیادی هماتوپوئتیک چیست؟
پیوند سلولهای بنیادی هماتوپوئتیک (HSCT) روشی برای جایگزینی سلولهای آسیبدیده مغز استخوان با سلولهای سالم از اهداکننده یا خود بیمار است که برای درمان سرطانهای خونی و اختلالات ایمنی استفاده میشود.
۲. ملاحظات ایمونوهماتولوژی در HSCT چه اهمیتی دارد؟
این ملاحظات شامل ارزیابی سازگاری ABO، HLA و آنتیبادیها است که برای جلوگیری از عوارضی مانند رد پیوند، همولیز و GVHD ضروری هستند.
۳. انواع ناسازگاری ABO در پیوند سلول های بنیادی چیست؟
ناسازگاری ABO به major (آنتیبادی گیرنده علیه اهداکننده)، minor (آنتیبادی اهداکننده علیه گیرنده) و bidirectional تقسیم میشود که هر کدام ریسکهای خاصی مانند همولیز ایجاد میکنند.
۴. آزمایشهای پیش از پیوند شامل چه مواردی است؟
شامل تایپینگ ABO/Rh، HLA typing، antibody screening (DAT، IAT)، isohemagglutinin titer و genotyping RBC برای ارزیابی سازگاری و ریسکها.
۵. engraftment در پیوند سلول های بنیادی چگونه نظارت میشود؟
با chimerism analysis (STR-PCR)، ABO typing و آزمایشهای خون مانند ANC >۵۰۰/μL برای نوتروفیلها و نظارت بر titer آنتیبادیها.
۶. عوارض شایع پس از پیوند چیست؟
عوارض شامل همولیز ایمنی، PRCA، PLS، GVHD و alloimmunization هستند که با داروها و ترانسفوزیون مدیریت میشوند.
۷. حمایت ترانسفوزیون در HSCT چگونه انجام میشود؟
با ترانسفوزیون RBC، پلاکت و گرانولوسیت بر اساس آستانههای خاص، و پردازش ویژه مانند irradiation و leukoreduction برای جلوگیری از عوارض.
۸. تفاوت autologous و allogeneic HSCT چیست؟
Autologous از سلولهای خود بیمار استفاده میکند و ریسک رد کمتری دارد، در حالی که allogeneic از اهداکننده است و اثر GVT دارد اما ریسک GVHD بالاتر است.
۹. چگونه ناسازگاری HLA مدیریت میشود؟
با HLA typing دقیق، DSA screening و درمانهایی مانند rituximab یا plasmapheresis برای کاهش ریسک رد پیوند.
۱۰. پیشرفتهای اخیر در ملاحظات ایمونوهماتولوژی HSCT چیست؟
شامل NGS برای genotyping، درمانهای هدفمند مانند belimumab و پروتکلهای conditioning کاهشیافته برای بهبود نتایج در بیماران پرریسک.