فهرست مطالب
اهداف یادگیری
دانشحو باید در پایان فصل:
- فرایند امبریوژنز را تعریف کند.
- واژه ی خون سازی (هماتوپوئز) را به صورت علمی و همراه جزئیات تعریف کند.
- روند و مکان های خونسازی را از دوره ی رویانی تا بلوغ شرح دهد.
- ویژگی های اساسی سلول های بنیادی و انواع سلول های بنیادی را بر اساس پتانسیل تمایزی توصیف کند.
- ویژگی های سلول های بنیادی خونساز و پروژنیتور های خونی و ایمنوفنوتایپ این سلول ها را بیان کند.
- طبقه بندی فاکتورهای رشد خون ساز را از نظر نحوه ی عملکرد و مکان عملکرد شرح دهد.
- فاکتورهای رشد خونساز مختلف و عملکرد آن ها را شرح دهد.
- فاکتورهای رونویسی مهم دخیل در خونسازی و نقش آن ها را نام ببرد.
جهت عضویت در کانال آموزشی در تلگرام به لینک زیر مراجعه کنید:
https://t.me/hematology_education
امبریوژنز
امبریوژنز که از نظر زمانی، هشت هفته ی اول بعد از ترکیب اسپرم و تخمک را شامل می شود، فرایندی است که طی آن رویانِ انسان شکل میگیرد و تکامل مییابد.
در انسان (و پستاندارن ) اولین مرحله در روند امبریوژنز، تشکیل سلول تخم (زیگوت) است که از لقاح سلول اسپرم و تخمک به وجود می آید. به این فرایند، بارورسازی گفته می شود. در ادامه سلول تخم که یک سلول دیپلوئید است دچار تقسیمات متوالی می شود و به مورولا (توده ی 16-32 سلولی) و سپس بلاستولا (توده ی 32-128 سلولی) تبدیل می شود.
در ادامه ی مسیر تکامل و در طی هفتهی سوم (روز های 14-21) فرایند گاسترولاسیون رخ میدهد. گاسترولاسیون یک مرحلهی کلیدی تکامل است که طی آن لایه های مختلف رویان شامل اکتودرم، مزودرم و اندودرم شکل میگیرند. در ادامه هریک از این لایه های زایا بخشی از اندام های بدن را تشکیل می دهند.
لایه ی مزودرم که لایهی زایای میانی است به عضلات، بافت همبند پوست، خون، مغز استخوان، قلب، عروق و غضروفها تبدیل میشود.
خون سازی
به حفظ تعداد کافی از سلولها برای انجام فعالیت های ارگانیسم، هموستاز بافتی گفته می شود که به تعادل دقیق بین تکثیر، تمایز و مرگ سلول ها (آپوپتوز) بستگی دارد. وقتی به هموستاز خون در گردش خون توجه کنیم، با سیستم چالش برانگیزی مواجه می شویم، چرا که اکثریت این سلول ها، سلول های بعد از میتوزی هستند که عمر کوتاهی دارند. به این معنا که وقتیکه این سلول ها به پایان عمر خود می رسند به طور طبیعی نمی توانند جایگزینی برای خود تولید کنند. به عنوان مثال به عددهای زیر توجه کنید: در هر ثانیه سه ملیون عدد گلبول قرمز به پایان عمر ۱۲۰ روزه ی خود می رسند و تخریب می شوند و باید به همین میزان گلبول قرمز تولید شود. روزانه به ازای هر کیلوگرم وزن انسان 5/2 میلیارد گلبول قرمز، 5/2 میلیارد پلاکت و حدود ۱میلیارد گلبول سفید تولید میشود. وقتی این اعداد را برای یک فرد بالغ ۷۰ کیلوگرمی که ۶۰ سال عمر می کند در نظر میگیریم به اعداد اعجاب برانگیزی می رسیم و این سوال برای ما مطرح می شود که چه معماری عظیمی در فرایند خون سازی تعبیه شده است؟ در ادامه به بحث درباره ی این موضوع می پردازیم.
خون سازی فرایندی منظم، مداوم و تحت کنترل است که منجر به تولید انواع سلول های خونی از سلول های بنیادی خونساز (HSCs) می شود.
این فرایند از زمان رویانی آغاز می شود و به طور مداوم تا دوران پیری و مرگ ادامه می یابد.
در هر دوره ی تکاملی نظم خاصی بر فرایند خون سازی حاکم است. به عنوان مثال در ابتدای دوره ی رویانی عمدتا گلبولهای قرمز تولید می شوند چرا که در این دوره که رویان به شکل یک توپ سلولی است خونریزی و عفونت برای آن مطرح نیست و تنها مسالهی مهم رساندن اکسیژن به سلول هاست. یا اینکه در مورد گلبول های سفید در کودکی اکثر سلول ها لنفوسیت هستند ولی در بالغین برتری با نوتروفیل ها است.
فرایند خون سازی به شدت تحت کنترل است تا از تولید بیش از حد و یا کمتر از حد نیاز سلول های خونی جلوگیری کند. تولید بیش از حد سلولهای خونی میتواند منجر به سرطان شود و کاهش تولید سلولهای خونی می تواند منجر به آنمی، ترومبوسایتوپنی و لکوپنی شود.
کنترل فرایند خونسازی عمدتا تحت تاثیر سایتوکاینها است که فرایند خون سازی را هم به صورت منفی و هم به صورت مثبت کنترل میکنند.
به طور کلی فرایند خون سازی را می توان به دو دوره تقسیم بندی کرد. خون سازی قبل از تولد و خون سازی بعد از تولد. خون سازی قبل از تولد خود شامل دو مرحله ی اولیه و نهایی تقسیم می شود.
تکامل قبل از تولد انسان شامل سه دوره اساسی است:
- از تشکیل زیگوت تا هفته ی دوم: دوره ی ژرمینال
- از هفته ی 3 تا هفته ی 8 (پایان ماه دوم): دورهی رویانی
- از هفته ی 9 (شروع ماه سوم) تا زمان تولد: دورهی جنینی
در روز 14، سلولی به نام همانژیوبلاست تمایز می یابد و به سلول های اندوتلیوم و HSC اولیه تبدیل می شود.
خون سازی اولیه در یک عضو خارج رویانی به نام کیسه ی زرده صورت می گیرد. خون سازی در کیسه ی زرده از روز ۱۴ (هفتهی دوم) آغاز می شود و در روز ۱۹ به اوج خود میرسد و در روز ۴۵ متوقف می شود.
کیسه ی زرده یک اندام نیم سانتی متری (5 میلی متر) است و یک عضو خارج رویانی بوده که خون سازی در آن به صورت داخل عروقی انجام میشود. در کیسه ی زرده عمدتا گلبولهای قرمز تولید می شوند. اریتروسیت های تولید شده در کیسه ی زرده هسته دار و حاوی هموگلوبین های رویانی به نام های هموگلوبین پورتلند و گاور هستند که مگالوبلاست بوده و حجم آن ها 400 فمتولیتر است و 100 پیکوگرم هموگلوبین دارند (MCV برابر 400 و MCH برابر 100).
در روز ۲۹، خون سازی نهایی در عضوی به نام PASP/AGM آغاز میشود.
در مراحل بعدی به ترتیب جفت (پلاسنتا)، کبد جنینی، طحال، گره های لنفاوی و مغز استخوان خون سازی را انجام می دهند. خونسازی در PASP/AGM، جفت، کبد جنینی، طحال، گره های لنفاوی و مغز استخوان به نام خونسازی نهایی خوانده میشود.
خون سازی در کبد از هفته ی ۶ آغاز می شود و در آغاز و اواسط دوره ی جنینی، کبد عضو اصلی خون سازی است. مقدار کمی سلول در طحال و گره های لنفاوی تولید می شود. گلبول های قرمز تولید شده در کبد ماکروسیت و فاقد هسته هستند و همچنین تعداد کمی از سایر رده های سلولی نیز در کبد تولید می شود. خون سازی در کبد یک هفته پس از تولد متوقف می شود.
از ماه پنجم حاملگی سلول های بنیادی خون ساز به مغز استخوان مهاجرت میکنند و از این زمان به بعد تا پایان عمر، مغزاستخوان محل اصلی خون سازی است. گلبول های قرمز تولید شده در مغز استخوان، نورموسیت و فاقد هسته هستند.
به این ترتیب:
- در دوره ی رویانی کیسه ی زرده محل اصلی خون سازی است.
- در ابتدا و اواسط دوره ی جنینی کبد محل اصلی خون ساری است.
- در انتهای دوره ی جنینی تا پس از تولد مغز استخوان محل اصلی خون سازی است.
در شکل ۱. روند تکامل خونسازی در بافت های مختلف را مشاهده می کنید.
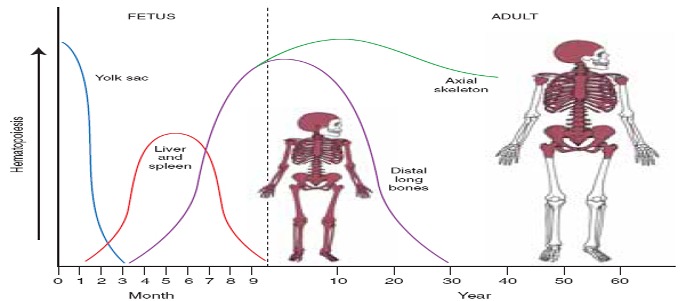 شکل ۱. روند تکامل خون سازی
شکل ۱. روند تکامل خون سازی
سلولاریته مغز استخوان
به نسبت حجم بافت خونساز به حجم کل بافت مغز استخوان، سلولاریته ی مغز استخوان گفته می شود که به تدریج با افزایش سن کمتر می شود. بیشترین سلولاریته در نوزادی و کمترین مقدار آن در پیری است. در سن میانسالی (۵۰ سالگی) متوسط سلولاریتهی مغز استخوان به شرح زیر است. مهره ها: ۷۵ درصد، جناغ: ۶۰ درصد، ستیغ ایلیاک ۵۰ درصد، دنده ها: ۳۰ درصد.
مغز استخوان در بالغین جرمی حدود 3/1 تا 5/1 کیلوگرم دارد.
بعد از تولد دو نوع خون سازی وجود دارد:
- Hematopoiesis Medullary: خون سازی در مغز استخوان
- Extra Medullary Hematopoiesis: خونسازی خارج مغز استخوانی در کبد و طحال. به این حالت، متاپلازی اطلاق میشود که به دلیل فعالیت بیش از حد کبد و طحال، بزرگی این دو اندام (هپاتومگالی و اسپلنومگالی) را در پی دارد. خون سازی خارج مغز استخوان در شرایطی رخ می دهد که فشار بیش از حد به مغز استخوان وارد شود، مثلا در بدخیمی های هماتولوژیک.
سلولهای بنیادی
سلولهای بنیادی که به نام سلولهای مادر خوانده می شوند سلولهای تمایز نیافته ای هستند که توانایی تمایز یافتن به رده های سلولی مختلف و همچنین توانایی تقسیم شدن و تولید تعداد بیشتری سلول های بنیادی را دارند. سلول های بنیادی وظیفه ی تبدیل شدن به بافت های سوماتیک، ترمیم و نوسازی بافت های فرسوده و آسیب دیده، رشد ناخن و اپیتلیوم، ارگان زایی و خون سازی در کل عمر را بر عهده دارند.
سلول های بنیادی به مقدار زیاد در مغز استخوان و بند ناف وجود دارند و البته در بافت های بالغین مثل روده، ریشهی دندان و … نیز به مقدار زیاد یافت می شوند.
سلولهای بنیادی دارای دو ویژگی اصلی (ماژور) هستند که شامل خودنوسازی و تمایز می باشد.
در مسیر تمایز سلول های بنیادی سه اصطلاح مهم، کاربرد ویژه ای دارند:
- Expansion یا تکثیر بدون تمایز: طی این فرایند بدون اینکه سلول به مرحله ی بالغ تری برسد یا به سلول دیگری تمایز یابد تقسیم می شود و به دو سلول مشابه خود تبدیل می شود. به این تقسیم، تقسیم متقارن گفته می شود که باعث خودنوسازی می شود.
- تقسیم نا متقارن یا تقسیم همراه تمایز: در این نوع تقسیم سلول تقسیم می شود و به دو سلول، یکی مشابه سلول بنیادی و یکی متفاوت با سلول بنیادی تقسیم می شود. به این تقسیم، تقسیم نامتقارن میگویند.
- Differentiation یا تمایز محض: در آن سلول بدون اینکه تقسیمی انجام دهد به سلولی با ویژگی های متفاوت تمایز می یابد. این فرایند عمدتا در سلول های پره کورسور انتهایی دیده می شود مثل تمایز اورتوکروماتیک نورموبلاست به رتیکولوسیت یا تمایز متامیلوسیت به سلول باند.
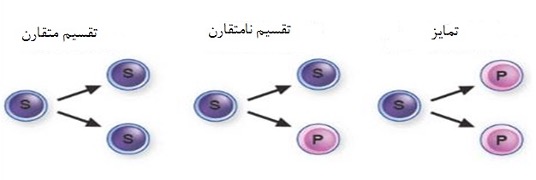 تقسیم سلول بنیادی
تقسیم سلول بنیادی
همه ی سطوح سلول های بنیادی دارای توانایی تمایز می باشند ولی خودنوسازی به تدریج همراه بلوغ کاهش می یابد.
مغز استخوان دارای دو جمعیت سلول های بنیادی است که شامل سلول های بنیادی خونساز (HSCs) و سلول های بنیادی مزانشیمی (MSCs) میباشند.
HSCs به انواع سلول های خونی تبدیل می شود. MSC جمعیت هتروژنی بوده و می تواند به استخوان، غضروف، چربی و … تمایز یابد.
از بافت های بالغی که دارای سلولهای بنیادی هستند می توان به مغز، غضروف، خون محیطی، رگ های خونی و روده اشاره کرد.
از نظر پتانسیل و عملکرد سلول های بنیادی را در ۳ گروه اصلی طبقه بندی می کنند:
- سلول های بنیادی totipotent یا همه ظرفیتی: این سلول ها سلول های اولیه ی حاصل از لقاح تخمک و اسپرم هستند و می توانند به هر نوع بافت یا سلول دیگری تبدیل شوند. این سلول ها می توانند به اجزای رویانی و نیز اجزای خارج رویانی (مثل جفت و کیسه ی آمنیوتیک) تبدیل شوند و بنابراین می توانند یک موجود کامل را تولید کنند.
- سلول بنیادی pluripotent یا پرظرفیتی (پرتوان): این سلولها میتوانند به هر نوع سلول دیگر به جز سلول totipotent تبدیل شوند. این سلول ها قادر به تولید سه لایه ی زایای جنینی هستند ولی قادر به تولید یک موجود کامل نیستند چون نمی توانند اجزای خارج رویانی را تولید کنند. سلول های بنیادی امبریونیک (رویانی) از این نوع سلول ها هستند.
- سلول های بنیادی multipotent یا چند ظرفیتی: به سلول های بنیادی حاصل از یکی از سه لایه ی جنینی (مزودرم، اکتودرم یا اندودرم) سلول های مولتیپوتنت میگویند. سلولهای بنیادی بالغین از این دسته اند. این سلولها تنها می توانند یک خانواده ی سلولی کاملا مرتبط مثل سلول های مزانشیمی یا سلول های خونی را تولید کنند.
سلول های بنیادی خونساز (HSCs) و سلول های بنیادی مزانشیمی (MSCs) از نوع سلول های مولتی پوتنت هستند.
بعد از سلول های بنیادی، سلول ها طی فرایند تمایز و با تبدیل شدن به سلول های پروژنیتور یا پیش تاز و سپس پره کورسور یا پیش ساز به سلول نهایی تبدیل می شوند.
سلولهای بنیادی خون ساز
HSC ها دسته ای از سلول های بنیادی بالغین هستند که توانایی تبدیل شدن به همه ی سلول های خونی را دارند.
روند تمایز HSC به سلول های خونی مختلف را در شکل ۳ مشاهده میکنید.
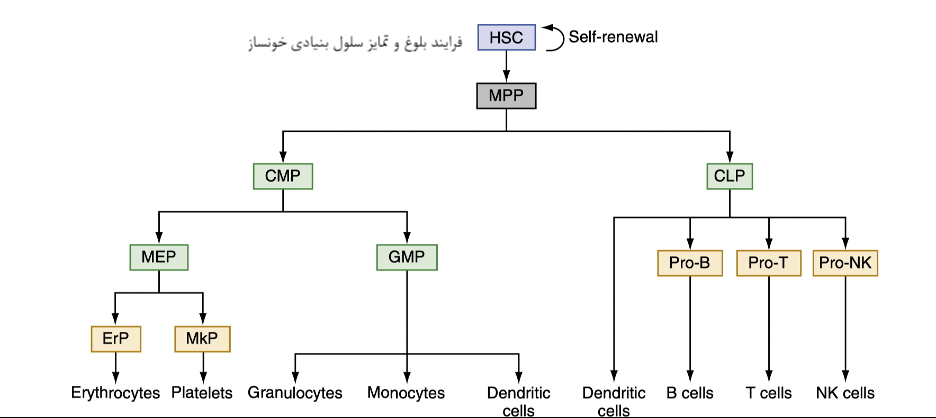 فرایند بلوغ و تمایز سلول بنیادی خونساز
فرایند بلوغ و تمایز سلول بنیادی خونساز
با استفاده از تکنیک های ایمنولوژیک مثل فلوسایتومتری می توان شاخص های بیان شده بر روی سلولهای بنیادی و سایر سلول های خونی را تشخیص داد. به این روش آزمایشگاهی، ایمنوفوتایپینگ گفته میشود. ایمنوفنوتایپ عبارت است از الگوی مجموعهی آنتیژن های بیان شده و یا بیان نشده بر سطح سلول.
ایمونوفنوتایپ HSC ها به شرح زیر است:
Lin − CD34 + CD38 − CD90 + CD45RA − CD49f +
منظور از Lin – این است که مارکرهای مخصوص رده های میلوئیدی و لنفوئیدی مثل CD2, CD3, CD4, CD7, CD8 CD10, CD11b, CD14, CD19, CD20, CD56, CD71, و glycophorin A بر سطح آن بیان نمی شوند.
HSC ها کمتر از ۱ درصد سلول های BM را تشکیل می دهند و به مقدار خیلی کم در خون محیطی نیز یافت می شوند. اکثر HSC ها در فاز خاموشی (فاز G0) چرخه سلولی قرار دارند.
مارکر های تمایز رده ای به شرح زیر میباشند:
- میلوئیدی(گرانولوسیت ها) CD33, CD11b, MPO و CD14
- مونوسیت/ماکروفاژ CD4, CD14, CD64, CD15 AND MAC1
- اریتروئیدی CD71 و GP A(CD235a)
- مگاکاریوسیتی CD41/CD61/CD42
- لنفوسیت B CD10, CD19
- لنفوسیت T CD3,CD5, CD7,و CD8 یا CD4
در مغز استخوان سلول های بنیادی در جایگاه ویژه ای به نام نیچ (به معنی کنام) مستقر هستند. نیچ جایگاه آناتومیکی ویژه و ریزمحیطی فراهم می کند که سلول های بنیادی بتوانند در آنجا مستقر شده و به عمر خود ادامه بدهند. گروهی از مولکول ها مثل کموکاین ها، لانه گزینی و حرکت سلول های بنیادی خونساز را در BM کنترل می کنند. مهمترین مولکولی که منجر به لانه گزینی سلولهای بنیادی میشود مولکولی به نام CXCL12 است که به نام SDF نیز خوانده میشود و یک کموکاین است که توسط سلول های استرومال BM تولید میشود و از طریق میانکنش با گیرندهی کموکاینیِ CXCR4 منجر به لانه گزینی سلولهای بنیادی میشود.
G-CSF با کاهش برهمکنش CXCR4 با CXCL12 منجر به حرکت سلولهای بنیادی از BM به خون محیطی میشود.
برای ارزیابی تعداد سلولهای بنیادی میتوان از فلوسایتومتری یا ایمونوهیستوشیمی برای شاخصهای CD34 و CD133 استفاده کرد.
فاکتورهای رشد خونساز
فاکتورهای رشد خونساز، گلیکوپروتئینهای اسیدی هستند که تکثیر و تمایز سلول های پیشساز خون و همچنین در برخی موارد عملکرد سلولهای خونی بالغ را تسهیل میکنند. عوامل رشد خونساز ممکن است به صورت موضعی و در نزدیکی محلی که تولید شده اند عمل کنند و یا اینکه در خون جریان پیدا کنند و در محلی دورتر عمل کنند. این فاکتور ها توسط سلول های مختلفی تولید می شوند و معمولا بیش از یک رده ی سلولی را تحت تاثیر قرار می دهند. فاکتور های رشد معمولا به صورت سینرژیک (هم افزا) با دیگر فاکتور ها عمل می کنند و ممکن است علاوه بر سلول های نرمال، سلول های بدخیم را نیز تحت تاثیر قرار بدهند.
از نظر محل عملکرد، فاکتورهای رشد خونساز را به انواع زیر طبقه بندی می کنند:
- اُتوکراین: بر روی سلول های سازنده ی خودشان عمل می کنند.
- پاراکراین: به طور موضعی و در نزدیک محلی که تولید شده اند عمل می کنند مثل SCF.
- اندوکراین: یعنی بر محلی دورتر از محل تولید اثر میگذارند مثل EPO که در کلیه تولید می شود و بر BM اثر میگذارد.
- جوکستاکراین: یعنی در تماس مستقیم سلول تولیدکننده با HSC اثر خود را اعمال می کند مثل Angiopoietin بر سطح استئوکلاست ها
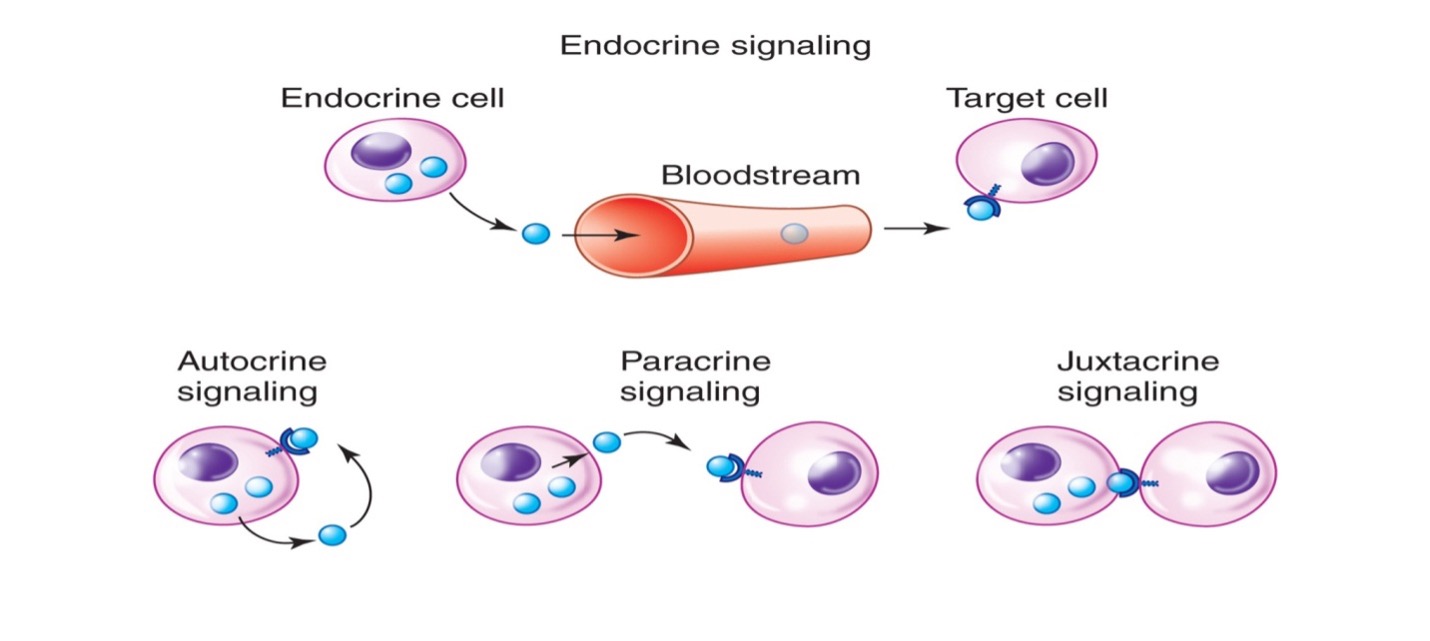
مکانیسم اثر فاکتور های رشد
فاکتورهای رشد از نظر نحوه ی عملکرد به چند شکل عمل می کنند:
- پلئوتروپیسم: معمولا بیش از یک رده ی سلولی را تحت تاثیر قرار می دهند. این ویژگی به فاکتورهای رشد این امکان را می دهد که مثل IL-3 بر روی چند رده با هم تاثیر کنند و در نتیجه فعالیت های بیولوژیک متنوعی داشته باشند.
- ردوندانسی: به این معناست که فاکتورهای مختلف اثر یکسانی داشته باشند.
- سینرژیک: به این معناست که دو فاکتور رشد اثر یکدیگر را تقویت کنند.
- آنتاگونیست: به این معناست که یک فاکتور عملکرد فاکتور دیگر را مهار کند یا کاهش بدهد.
فاکتور های رشد ممکن است همانند سلول های طبیعی، بر روی سلول های نئوپلاستیک نیز اثر بگذارند (مثل IL6).
عوامل رشد اغلب تمایل به افزایش یکپارچگی غشاء و جلوگیری از آپوپتوز دارند.
مهمترین فاکتورهای رشد خونساز به شرح زیر هستند:
اریتروپوئتین (EPO)
EPO مهمترین فاکتور رشد برای تمایز رده ی اریتروئیدی است و منجر به افزایش رشد و تکثیر پیشسازهای اریتروئیدی و در نتیجه افزایش تولید گلبولهای قرمز میشود.
EPO دارای ساختار گلیکوپروتئینی و بسیار گلیکوزیله است. گلیکوزیله شدن برای عملکرد EPO و افزایش نیمه عمر آن ضروری است.
اولین مکان تولید EPO قبل از تولد در کبد است اما پس از تولد، حدود 90 درصد EPO در کلیه و با واسطه ی فاکتور رونویسی HIF-1 و 10 درصد آن در کبد و بدون واسطه ی HIF-1 تولید میشود.
بیماریهای شدید کلیوی با کاهش تولید EPO و بروز آنمی شدید همراه هستند. تجویز EPO نوترکیب که به نامهای تجاریِ Epogen و eprex نیز خوانده میشود تحول عظیمی در درمان آنمی ناشی از بیماریهای کلیوی ایجاد کرد.
EPO در نتیجه ی هایپوکسی و عمدتا در پاسخ به فاکتور رونویسی HIF1α تولید میشود. اتصال EPO به EPOR باعث فعال شدن مسیر سیگنالینگ JAK2/STAT5 میشود که در نتیجه تکثیر، تمایز و رشد پیشسازهای اریتروئیدی را تحریک میکند و منجر به افزایش تولید اریتروسیتها میشود.
نکته ی قابل توجه این است که EPO دارای ذخیره نمیباشد و در پاسخ به هایپوکسی و تولید فاکتور رونویسی HIF از کلیه تولید میشود.
ترومبوپوئتین (TPO)
TPO یک گلیکوپروتئین است که عمدتا توسط کبد و به مقدار کمتر توسط استرومای استخوان و کلیه تولید میشود و جهت تولید و بلوغ مگاکاریوسیتها ضروری است و منجر به افزایش تولید و تمایز مگاکاریوسیتها و پلاکتها میشود.
G-CSF (فاکتور تحریککنندهی کلونی گرانولوسیت)
این فاکتور، مهمترین فاکتور تحریککنندهی نوتروفیلهاست و تولید گرانولوسیتها و فعال شدن آنها را تحریک میکند. از طرف دیگر G-CSF با اثر بر روی HSCهایی که در فاز G0 چرخه سلولی قرار دارند منجر به ورود آنها به چرخهی تکثیر (G1/S) میشوند.
G-CSF برای مقابله با نوتروپنی استفاده میشود و سمیت کمتری نسبت به GM-CSF تولید میکند. همچنین قابل ذکر است که G-CSF شایعترین فاکتور رشد مورد استفاده جهت به حرکت درآوردن سلولهای بنیادی از BM به خون محیطی (در پیوند سلولهای بنیادی) است که این عملکرد خود را از طریق اثر بر روی پیوند CXCR4 و CXCL12 القا میکند. شکل دارویی G-CSF به نام نئوپوژن (neopogen) یا فیلگراستیم (filgrastim) خوانده میشود و از طریق فناوری DNA نوترکیب تولید میشود.
M-CSF (فاکتور تحریککنندهی کلونی مونوسیت-ماکروفاژ)
این فاکتور که تحت عنوان CSF-1 هم خوانده میشود باعث تحریک تولید و فعالیت مونوسیتها و ماکروفاژ و نیز افزایش تولید اینترلوکین 1 از ماکروفاژها میشود.
GM-CSF (فاکتور تحریککنندهی کلونی گرانولوسیت-ماکروفاژ)
یک فاکتور رشد پانمیلوئید (عمومی) است که باعث تحریک پیشسازهای اریتروئید، گرانولوسیت، مونوسیت، مگاکاریوسیت و ائوزینوفیل میشود و به طور عمده منجر به افزایش نوتروفیل و ائوزینوفیل و افزایش عملکرد بیگانهخواری آنها میشود.
IL-5
IL-5 توسط سلولهای Th2 ی فعال شده تولید میشود و مهمترین فاکتور رشد برای ائوزینوفیلها میباشد.
IL-7
IL-7 توسط سلولهای استرمال مغز استخوان و تیموس ترشح میشود و مهمترین فاکتور رشد دخیل در لنفوپوئز است و نقش اساسی در تکثیر سلولهای B و T و جلوگیری از آپوپتوز آنها دارد.
فاکتورهای رونویسی دخیل در هماتوپوئز
فاکتورهای رونویسی عموما دارای یک دومین (Domain) اتصال به DNA و یک دومین ترانس اکتیواسیون هستند. اتصال فاکتورهای رونویسی به مناطق تنظیمی DNA باعث افزایش و یا کاهش رونویسی از ژنهای خاصی میشود به عبارت دیگر فاکتورهای رونویسی، در تنظیم بیان ژن در سطح رونویسی نقش دارند.
مهمترین فاکتور رونویسی دخیل در تمایز اریتروسیتها: GATA1
مهمترین فاکتور رونویسی دخیل در تمایز لنفوسیتها: IKARUS
مهمترین فاکتور رونویسی دخیل در تمایز گرانولوسیتها: PU1 و CEBP
سوالات چهارگزینهای
- کدام لایه زایا در طی گاسترولاسیون مسئول تشکیل خون و مغز استخوان است؟
a) اکتودرم
b) مزودرم
c) اندودرم
d) لایههای رویانی اولیه - خونسازی اولیه در کدام عضو خارج رویانی رخ میدهد؟
a) کبد جنینی
b) کیسه زرده
c) مغز استخوان
d) طحال - کدام ویژگی سلولهای بنیادی خونساز (HSCs) را به طور خاص از سایر سلولهای مغز استخوان متمایز میکند؟
a) توانایی خودنوسازی و تمایز
b) تولید انحصاری گلبولهای سفید
c) عدم وجود مارکرهای تمایزی
d) تولید هموگلوبینهای رویانی - کدام فاکتور رشد خونساز به طور خاص برای تولید و بلوغ مگاکاریوسیتها و پلاکتها ضروری است؟
a) اریتروپوئتین (EPO)
b) ترومبوپوئتین (TPO)
c) G-CSF
d) IL-5 - مهمترین فاکتور رونویسی دخیل در تمایز گرانولوسیتها کدام است؟
a) GATA1
b) IKARUS
c) PU1 و CEBP
d) HIF1α - کدام نوع از سلولهای بنیادی قادر به تولید یک موجود کامل هستند؟
a) Pluripotent
b) Multipotent
c) Totipotent
d) Unipotent - ایمونوفنوتایپ سلولهای بنیادی خونساز (HSCs) شامل کدام مارکر است؟
a) CD34+
b) CD19+
c) CD71+
d) CD3+ - کدام فاکتور رشد خونساز به صورت اندوکراین عمل میکند؟
a) SCF
b) EPO
c) Angiopoietin
d) IL-3 - کدام دوره از تکامل قبل از تولد شامل هفتههای 3 تا 8 است؟
a) دوره ژرمینال
b) دوره رویانی
c) دوره جنینی
d) دوره بلاستوسیست - کدام مولکول در لانهگزینی سلولهای بنیادی خونساز در مغز استخوان نقش کلیدی دارد؟
a) G-CSF
b) CXCL12
c) IL-7
d) EPO
کلید سوالات
- پاسخ: b) مزودرم
- پاسخ: b) کیسه زرده
- پاسخ: a) توانایی خودنوسازی و تمایز
- پاسخ: b) ترومبوپوئتین (TPO)
- پاسخ: c) PU1 و CEBP
- پاسخ: c) Totipotent
- پاسخ: a) CD34+
- پاسخ: b) EPO
- پاسخ: b) دوره رویانی
- پاسخ: b) CXCL12
