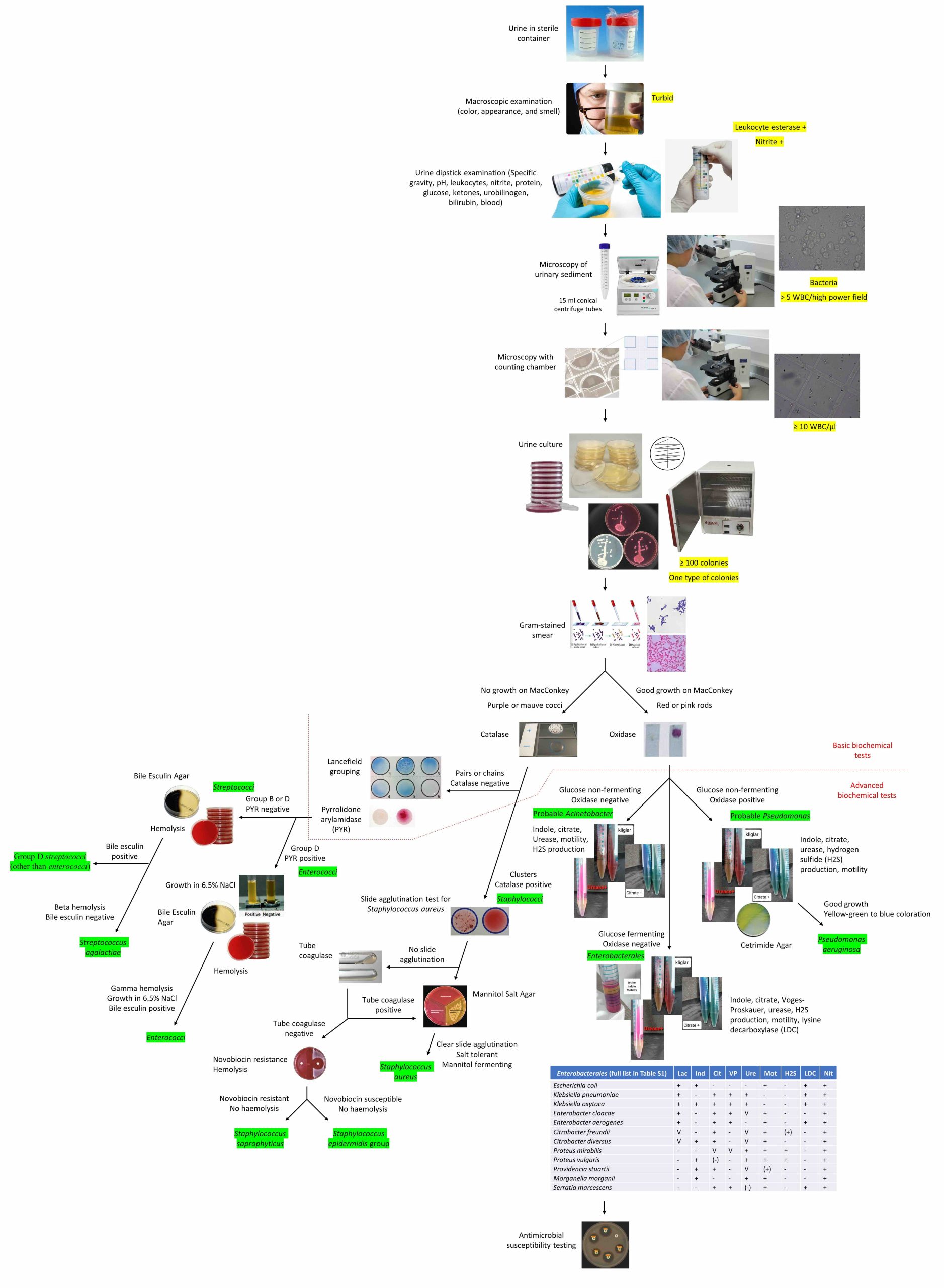
رویکرد تشخیصی به کشت مثبت ادرار: الگوریتم گامبهگام تا شناسایی نهایی میکروارگانیسم
رویکرد تشخیصی به کشت مثبت ادرار یعنی تفسیر کشت را فقط به «رشد» محدود نکنیم و با ترکیب پیشتحلیل، آزمایش کامل ادرار (Urinalysis)، الگوی رشد و مسیر شناسایی، به یک گزارش قابل دفاع برسیم.
این مقاله یک الگوریتم اجرایی برای کارشناسان آزمایشگاه ارائه میدهد تا از «کشت مثبت» به «تشخیص نهایی میکروارگانیسم (Final Identification)» و تصمیم درست برای آنتیبیوگرام برسند.
بعد از خلاصه جهت عضویت در کانال آموزشی در تلگرام به لینک زیر مراجعه کنید:
https://t.me/hematology_education
فهرست مطالب
خلاصه سریع
خلاصه
رویکرد تشخیصی به کشت مثبت ادرار به این شکل است که ابتدا کیفیت نمونه و یافتههای Urinalysis را بررسی کنیم، سپس بر اساس الگوی رشد و تفسیر نیمهکمی کشت، فقط رشدهای قابل تفسیر را وارد مسیر شناسایی نهایی (Final Identification) کنیم. در نهایت، آنتیبیوگرام (Antimicrobial Susceptibility Testing) فقط زمانی انجام میشود که پاتوژن محتمل و بالینیمحور تایید شده باشد.
مقدمه: رویکرد تشخیصی به کشت مثبت ادرار چرا حساس است؟
کشت ادرار یکی از پرتکرارترین خروجیهای بخش میکروبیولوژی است، اما در عین حال یکی از بیشترین منابع خطای تشخیصی و درمانی نیز محسوب میشود. برخلاف بسیاری از نمونههای استریل دیگر، مثبت شدن کشت ادرار الزاماً به معنای وجود عفونت فعال دستگاه ادراری نیست. آلودگی نمونه در حین جمعآوری، کلونیزاسیون (بهویژه در بیماران دارای کاتتر) (Catheter colonization)، باکتریوری بدون علامت (Asymptomatic bacteriuria) و overgrowth ناشی از تأخیر در انتقال نمونه، همگی میتوانند منجر به رشد میکروبی شوند. از این رو، ارزش واقعی کشت ادرار نه در «رشد دادن» بلکه در تفسیر صحیح رشد نهفته است.
نکته مهم: نقش آزمایشگاه در رویکرد تشخیصی به کشت مثبت ادرار صرفاً فنی نیست؛ بلکه تصمیمساز است. اینکه کدام رشد شناسایی شود، کدام نادیده گرفته شود، و در چه مواردی آنتیبیوگرام انجام گردد، مستقیماً بر تصمیم درمانی پزشک و مصرف آنتیبیوتیک اثر میگذارد.
برای استانداردسازی عملکرد آزمایشگاه و جلوگیری از خطاهای سیستماتیک، این مقاله را هم ببینید:
کنترل کیفی میکروب شناسی: اصول، روشها و استانداردهای عملکردی
تحلیل پیشتحلیلی در رویکرد تشخیصی به کشت مثبت ادرار (Pre-Analytical Assessment)
فرآیند تشخیص در کشت ادرار پیش از باز شدن درِ انکوباتور آغاز میشود. نوع نمونهگیری تعیین میکند که رشد مشاهدهشده تا چه حد نماینده وضعیت واقعی بیمار است. در نمونههای midstream clean-catch، حتی با رعایت اصول بهداشتی، ورود فلور ناحیه پرینه و پوست اجتنابناپذیر است. بنابراین مشاهده رشد مختلط یا ارگانیسمهایی با احتمال فلور طبیعی، در این نوع نمونه باید با احتیاط تفسیر شود.
در نمونههای کاتتریزه، موضوع کلونیزاسیون اهمیت ویژهای دارد. تشکیل بیوفیلم (Biofilm) روی کاتتر میتواند باعث حضور پایدار باکتری در ادرار شود، بدون آنکه عفونت فعال وجود داشته باشد. در این شرایط، مثبت شدن کشت ارزش اخباری کمتری دارد و تفسیر باید بهشدت وابسته به Urinalysis و زمینه بالینی باشد. در مقابل، نمونههای سوپراپوبیک (Suprapubic aspirate) به دلیل حداقل آلودگی، بالاترین ارزش تشخیصی را دارند و هر رشد میکروبی در آنها باید جدی تلقی شود.
عامل مهم دیگر، زمان انتقال و شرایط نگهداری نمونه است. تأخیر در کشت میتواند باعث افزایش کاذب شمارش کلنی و حتی تغییر ترکیب جمعیت میکروبی شود. در عمل، بسیاری از رشدهای «غیرقابل توجیه بالینی» نتیجه همین خطای پیشتحلیلی هستند. بنابراین کارشناس آزمایشگاه باید همواره این احتمال را در ذهن داشته باشد و در صورت عدم همخوانی الگوی رشد با UA، به کیفیت نمونه شک کند.
اگر از لوپهای کالیبره (Calibrated loops) برای کشت نیمهکمی استفاده میکنید، این راهنما را هم ببینید:
دستورالعمل جامع کنترل کیفی لوپ های کالیبره میکروبیولوژیک
ارتباط Urinalysis با رویکرد تشخیصی به کشت مثبت ادرار (Urinalysis Correlation)
هیچ کشت ادراری نباید جدا از Urinalysis تفسیر شود. UA نشاندهنده پاسخ میزبان است، در حالی که کشت فقط حضور میکروارگانیسم را نشان میدهد. پیوری (Pyuria) و لکوسیتاستراز (Leukocyte esterase) بیانگر التهاب هستند و همخوانی آنها با رشد میکروبی احتمال UTI واقعی را افزایش میدهد. در مقابل، کشت مثبت بدون شواهد التهابی، در بسیاری از موارد به نفع باکتریوری بدون علامت (Asymptomatic bacteriuria)، کلونیزاسیون یا آلودگی نمونه است.
نبود پیوری همیشه UTI را رد نمیکند (مثلاً در برخی بیماران خاص/نمونهگیری/رقیق بودن ادرار/آنتیبیوتیک قبلی…)، و
وجود پیوری هم همیشه به معنی عفونت باکتریال نیست (التهاب غیرعفونی، سنگ، …).
ASB در اغلب گروهها نیاز به درمان ندارد و آزمایشگاه با گزارشدهی محافظهکارانه و جلوگیری از AST بیمورد، کمک میکند.
مطابق گایدلاین IDSA، درمان/اسکرین عمدتاً محدود به بارداری و قبل از اقدامات اورولوژیک تهاجمی است.
نیتریت (Nitrite) مثبت میتواند به نفع برخی باسیلهای گرم منفی نیتریتساز باشد، اما نیتریت منفی هرگز عفونت را رد نمیکند. بنابراین UA باید بهعنوان یک مجموعه داده تفسیر شود، نه یک تست منفرد. این همخوانی UA با الگوی رشد است که تصمیم ادامه مسیر شناسایی را توجیه میکند.
الگوی رشد و تفسیر نیمهکمی در رویکرد تشخیصی به کشت مثبت ادرار (Semi-Quantitative Interpretation)
پس از رشد، اولین وظیفه کارشناس تعیین «قابلتفسیر بودن» کشت است. در رویکرد نیمهکمی با لوپ کالیبره (۱ µL)، رشد ≥۱۰۰ کلنی از یک نوع معمولاً معادل ≥10⁵ CFU/mL تلقی شده و بهعنوان رشد معنیدار در نظر گرفته میشود. رشد ۱۰ تا ۹۹ کلنی (۱۰⁴–۱۰⁵ CFU/mL) نیازمند تفسیر بالینی است و رشد کمتر از ۱۰ کلنی اغلب فاقد اهمیت بالینی محسوب میشود. با ابن جال <10 کلنی معمولاً در midstream بدون علائم/UA همخوان کماهمیت است، با این حال در نمونههای کاتتریزه/سوپراپوبیک یا در بیمار علامتدار با UA همخوان، حتی شمارشهای پایینتر هم میتواند معنیدار باشد.
اگر دو نوع کلنی مشاهده شود و حداقل یکی از آنها ≥۱۰۰ کلنی داشته باشد، هر نوع با شمارش ≥۱۰۰ میتواند بهصورت جداگانه زیرکشت و بررسی شود، اما همزمان باید درخواست نمونه جدید مطرح گردد. مشاهده بیش از دو نوع کلنی در اغلب موارد نشانه آلودگی است و ادامه شناسایی کامل توصیه نمیشود. این مرحله، یکی از مهمترین نقاط کنترل خطا در کشت ادرار است و مانع ورود آلودگی به مسیر شناسایی و AST میشود.
نکته مهم: در رویکرد تشخیصی به کشت مثبت ادرار، «مختلط بودن رشد» فقط تعداد ارگانیسمها نیست؛ مشاهده بیش از دو مورفوتایپ معمولاً نشانه آلودگی نمونه است و ورود آن به مسیر شناسایی نهایی، گزارش را گمراهکننده میکند. اما در بیماران کاتتریزه/بستری/مشکوک به عفونت پیچیده، در صورت همخوانی بالینی و UA، نیاز به تصمیمگیری با سیاست داخلی آزمایشگاه (و گاهی تکرار نمونه) دارد.
تشخیص نهایی در رویکرد تشخیصی به کشت مثبت ادرار (Final Identification)
شناسایی نهایی قلب فرآیند تشخیصی است و باید تنها زمانی انجام شود که رشد قابل تفسیر باشد. این فرآیند از مشاهده پلیت آغاز میشود، نه از انجام تست. ابتدا باید تعیین شود آیا یک مورفوتایپ غالب وجود دارد یا خیر. غالب بودن به معنای یکنواختی مورفولوژی و برتری عددی نسبت به سایر کلنیهاست، نه صرفاً بزرگتر بودن ظاهری.
پس از انتخاب کلنی نماینده، تهیه زیرکشت خالص الزامی است. حتی در کشتهایی که ظاهراً خالصاند، زیرکشت احتمال ناخالصی پنهان را کاهش میدهد و دقت شناسایی و AST را افزایش میدهد. از کلنی خالص، رنگآمیزی گرم (Gram staining) انجام میشود که نقطه انشعاب اصلی مسیر شناسایی است.
برای اجرای استاندارد رنگآمیزی گرم و کاهش خطای مسیر شناسایی:
روش کار رنگ آمیزی گرم: اصول، روش و کاربردها
مسیر شناسایی برای باسیلهای گرم منفی در رویکرد تشخیصی به کشت مثبت ادرار (GNR Step-by-Step)
وقتی Gram stain از کلنی خالص نشان میدهد با باسیل گرم منفی مواجه هستید، هدف شما از همان لحظه باید این باشد که شناسایی را در دو مرحله مدیریت کنید: ابتدا یک شناسایی سطح ۱ انجام دهید که گروه عامل را مشخص کند و مسیر تستها را درست انتخاب کند، سپس در صورت نیاز وارد سطح ۲ شوید تا به جنس/گونه برسید. کلید موفقیت اینجاست که شما پیش از انجام هر تستی، چند تصمیم پایه اما حیاتی بگیرید: آیا رشد واقعاً نماینده یک پاتوژن غالب است؟ آیا کلنی انتخابشده واقعاً خالص است؟ آیا الگوی رشد و UA با هم همخوانی دارند؟ اگر این «سه بله» را نداشته باشید، احتمال اینکه حتی شناسایی درست هم به گزارش غلط منجر شود زیاد است.
در عمل، اولین تصمیم بزرگ برای GNR این است که آیا با یک Enterobacterales (رودهای/تخمیرکننده گلوکز و اغلب مرتبط با UTI کلاسیک) طرف هستید یا با یک non-fermenter (مثل Pseudomonas) که بیشتر در بیماران بستری، کاتتر، ICU و زمینههای خاص دیده میشود. این تصمیم را شما از ترکیب سه داده میگیرید: تصویر کلنی روی پلیت، رفتار روی MacConkey (و اگر در مجموعه دارید MacConkey گلوکزدار)، و نتیجه یک تست سریع مثل oxidase.
گام ۱: انتخاب کلنی نماینده در رویکرد تشخیصی به کشت مثبت ادرار (Representative Colony Selection)
در کشت ادرار، کلنیای که باید انتخاب شود، کلنیای است که نمایندهی مورفوتایپ غالب است. غالب بودن را با یکنواختی ظاهر کلنیها و غلبه عددی تعیین کنید. اشتباه رایج این است که یک کلنی خیلی بزرگ یا موکوئید را انتخاب کنیم در حالی که بخش عمده کلنیهای پلیت ظاهر دیگری دارند. اگر رشد یکدست است، انتخاب ساده است؛ اگر دو مورفوتایپ دارید، باید تصمیم بگیرید آیا هر دو ارزش کاراپ دارند یا یکی احتمالاً آلودگی است. این تصمیم را با UA کمک بگیرید: اگر پیوری واضح و یک مورفوتایپ با شمارش بالا دارید و مورفوتایپ دوم پراکنده و کمتعداد است، معمولاً مورفوتایپ غالب را کاراپ میکنید.
گام ۲: زیرکشت خالص در مسیر شناسایی GNR (Subculture for Purity)
حتی اگر پلیت اولیه خالص به نظر برسد، در GNR زیرکشت خالص اهمیت دوچندان دارد، چون بسیاری از اشتباهات ID و AST ناشی از مخلوط بودن نامحسوس کلنیهاست. شما با یک زیرکشت درست، فردا کلنیهای ایزوله خواهید داشت که هم برای oxidase و هم برای MALDI/اتومات و هم برای بیوشیمی دستی قابل اعتماد هستند. اگر آزمایشگاه شما سرعت را اولویت داده و همان روز ID میزند، بهتر است این کار فقط برای رشدهای واقعاً خالص و یکنواخت انجام شود و در هر مورد مشکوک، زیرکشت را شرط کنید.
گام ۳: خواندن مککانکی در رویکرد تشخیصی به کشت مثبت ادرار (MacConkey Reading)
MacConkey برای شما فقط یک محیط انتخابی نیست؛ یک ابزار تصمیمگیری است. اگر کلنیها صورتی/قرمز هستند، شما بهصورت عملی وارد سناریوی Enterobacterales میشوید و محتملترینها در UTI شامل E. coli و Klebsiella و برخی گونههای مرتبط مثل Enterobacter/Klebsiella aerogenes هستند. اما اگر کلنیها بیرنگ یا کمرنگ باشند، non-lactose fermenter مطرح میشود و باید سریع با oxidase مسیر را روشن کنید.
اینجا باید یک نکته کاملاً عملی و مهم را بهصورت “قانون ذهنی” در کارشناس تثبیت کنید: لاکتوزفرمنتر بودن همیشه واضح و فوری نیست. برخی ارگانیسمها «دیررس» رنگ میگیرند یا رنگ ضعیف دارند، و برخی شرایط انکوباسیون (مدت، دما، رطوبت) هم روی شدت رنگ اثر میگذارد. بنابراین قبل از اینکه یک کلنی کمرنگ را non-fermenter فرض کنید، به سن کلنی نگاه کنید، مقایسه با کلنیهای دیگر انجام دهید و اگر امکان دارید، روی MacConkey گلوکزدار هم نگاه کنید تا تخمیرکننده گلوکز از غیرتخمیرکننده بهتر جدا شود. نکته دیگر این است که «همه Enterobacteralesها لاکتوزفرمنتر قوی نیستند»؛ بنابراین مسیر تشخیص را نباید فقط به رنگ صورتی وابسته کرد، بلکه باید با oxidase و الگوی کلی تقویت شود.
برای تفسیر دقیق مککانکی (MacConkey agar) و خطاهای رایج:
محیط کشت مک کانکی: ترکیبات، کاربرد و تفسیر نتایج
گام ۴: اکسیداز در مسیر شناسایی GNR (Oxidase as a Decision Point)
وقتی با یک GNR روبهرو هستید، oxidase در سطح ۱ نقش یک «تقاطع» را دارد. اگر رشد روی MacConkey بیرنگ باشد و oxidase مثبت شود، در بستر ادرار یکی از گزینههای جدی Pseudomonas aeruginosa است، هرچند گونههای دیگر هم ممکناند. اگر oxidase منفی باشد، شما یا با Enterobacterales طرفید یا با برخی non-fermenterهای oxidase منفی مثل Acinetobacter و تعدادی دیگر که تفسیرشان به سناریو وابسته است.
برای اجرای oxidase هم دو نکته خیلی مهم است: اول اینکه باید از کلنی جوان و از محیط مناسب برداشت کنید، چون برخی محیطها و شرایط میتوانند نتیجه را تحت تأثیر قرار دهند؛ دوم اینکه خوانش باید در زمان استاندارد انجام شود، چون دیر خواندن یا آلودگی با فلز/وسایل نامناسب میتواند نتایج کاذب بدهد. کارشناس باید بداند oxidase مثبت/منفی در این مرحله یک «تست منفرد» نیست؛ تصمیمی است که مسیر هزینه و زمان را تعیین میکند.
برای روش انجام و کنترل کیفی تست اکسیداز (Oxidase test) این مقاله را ببینید:
روش انجام و کنترل کیفی تست اکسیداز: راهنمای جامع روشها، استانداردها و کاربردها
گام ۵: انتخاب سطح شناسایی و پنل تستها در رویکرد تشخیصی به کشت مثبت ادرار (Level 1 vs Level 2)
در اینجا شما باید تصمیم بگیرید آیا صرفاً «گروه عامل» برای گزارش اولیه و انتخاب AST کافی است یا باید به جنس/گونه برسید. در اغلب آزمایشگاهها، اگر MALDI-TOF یا سیستم اتومات دارید، رسیدن به ID گونهای آسانتر است اما همچنان شرطش خلوص و کنترل منطقی است. اگر ابزارهای کلاسیک دارید، انتخاب تستها باید هدفمند باشد و نباید تبدیل به “تستزدن کور” شود.
اگر MALDI یا اتومات دارید، شناسایی را از کلنی خالص انجام میدهید. نکتهای که در کار واقعی اهمیت دارد این است که خروجی سیستم را همیشه با منطق نمونه تطبیق دهید. اگر یک بیمار سرپایی با نمونه midstream و UA همخوان با UTI ساده دارید اما سیستم یک ارگانیسم عجیب بیمارستانی گزارش میکند، اولین اقدام شما نباید چاپ گزارش باشد؛ باید به خلوص کلنی، احتمال mixed growth پنهان، و نیاز به تکرار زیرکشت یا تایید با روش دوم فکر کنید. این همان «مرحله مکث» است که کیفیت کار را بالا میبرد.
اگر ابزار پیشرفته ندارید، وارد مسیر بیوشیمی دستی میشوید و اینجا باید بدانید هر تست چه سؤالی را جواب میدهد. برای Enterobacterales ادراری، سه محور کلیدی که سریعترین افتراق را میدهند Indole، Urease و Motility هستند و در صورت نیاز Citrate، VP، H2S و LDC اضافه میشوند تا پروفایل کامل شود. منطق این تستها این است که شما با کمترین تعداد تست، بیشترین قدرت افتراق را به دست آورید. Indole مثبت همراه با یک اوروپاتوژن تیپیک و رشد مناسب، احتمال E. coli را بسیار بالا میبرد. در مقابل، اگر کلنی موکوئید است و Urease مثبت و Indole منفی میشود، Klebsiella محتملتر میشود. اگر الگو بینابینی یا نتایج “نه این نه آن” هستند، شما باید وارد تستهای تکمیلی شوید تا بین گروههای نزدیک مثل Enterobacter cloacae complex و گونههای مرتبط افتراق دهید. این همان سطح ۲ است؛ جایی که پروفایل چندتستی شما را به ID نهایی میرساند.
برای Proteus spp. یک مسیر عملی بسیار کمککننده وجود دارد: اگر روی Blood agar الگوی swarming دیده شود و Urease قوی باشد، شما عملاً وارد مسیر Proteus میشوید و سپس با تستهای تکمیلی لازم ID را قطعی میکنید. نکته مهم این است که swarming همیشه در همه شرایط دیده نمیشود، اما وقتی هست، یک دادهی بسیار ارزشمند است و کارشناس باید آن را فعالانه جستوجو کند.
در مورد non-fermenterها، اگر MacConkey بیرنگ است و oxidase مثبت است و ویژگیهای کلنی با Pseudomonas همخوانی دارد، باید ID را با روش معتبر قطعی کنید، چون از نظر درمانی و کنترل عفونت اهمیت دارد. اگر non-fermenter و oxidase منفی باشد، Acinetobacter یا دیگران مطرح میشوند و اینجاست که نقش زمینه (بستری/ICU/کاتتر) و همچنین روش تاییدی پررنگ میشود. پیام کلیدی برای کارشناس این است که non-fermenterها را نباید با چند تست محدود «حدس زد» و گزارش قطعی داد؛ باید یا به سطح ۲ بیوشیمی وارد شد یا از ابزار تاییدی استفاده کرد.
گام ۶: کنترل کیفیت قبل از نهاییسازی در مسیر GNR (Pre-Report Quality Gate)
پیش از اینکه ID را نهایی کنید، باید یک چک ساده اما حیاتی انجام دهید: آیا ارگانیسم شناساییشده با نوع نمونه، الگوی رشد، و دادههای UA سازگار است؟ اگر تناقض وجود دارد، معمولاً یکی از اینها مشکل دارد: انتخاب کلنی غلط بوده، خلوص ناقص است، نمونه آلوده بوده، یا شرایط پیشتحلیلی باعث overgrowth شده است. این مرحله مکث، چیزی است که در SOPها باید بهصورت رسمی وارد شود، چون عامل اصلی کاهش خطای گزارش است.
مسیر شناسایی برای کوکسیهای گرم مثبت در رویکرد تشخیصی به کشت مثبت ادرار (GPC Pathway)
وقتی Gram نشان میدهد با کوکسیهای گرم مثبت مواجه هستید، اشتباه کلاسیک این است که آن را سریع «آلودگی» تلقی کنید. در ادرار، Enterococcus و در برخی سناریوها Staphylococcus saprophyticus و همچنین Staphylococcus aureus اهمیت واقعی دارند و بیدقتی در این شاخه میتواند باعث گزارش اشتباه یا از دست رفتن یک یافته مهم شود.
نقطه شروع catalase است، چون شما را به دو مسیر کاملاً متفاوت میبرد. catalase منفی شما را به سمت Enterococcus/Streptococcus-like هدایت میکند. اینجا کارشناس باید بین Enterococcus و استرپتوکوکهای گروهی افتراق دهد و سپس در صورت سیاست آزمایشگاه، تفکیک گونهای Enterococcus انجام شود، چون در برخی مراکز تفاوتهای مقاومت و پیامد درمانی مهم است. در مسیر کلاسیک، تستهایی که رفتار گروه D را نشان میدهند و توانایی رشد در شرایط نمکی را بررسی میکنند به شما کمک میکنند. اگر MALDI/اتومات دارید، ID سریع است اما همچنان خلوص شرط اول است و هر خروجی غیرمنتظره باید با کنترل کیفیت بررسی شود.
catalase مثبت شما را وارد مسیر Staphylococcus میکند. در این شاخه، coagulase برای افتراق S. aureus از CoNS اهمیت حیاتی دارد. اگر coagulase مثبت باشد، شناسایی باید با دقت بالا انجام شود، چون S. aureus در ادرار میتواند پیام بالینی مهم داشته باشد و نباید به عنوان یک یافته ساده UTI کنار گذاشته شود. اگر coagulase منفی باشد، دو سناریو دارید: یا با CoNSهای معمولی طرفید که در نمونه midstream اغلب آلودگی/فلور هستند، یا با S. saprophyticus که در زنان جوان میتواند اوروپاتوژن واقعی باشد. نکته مهم برای کارشناس این است که S. saprophyticus ممکن است حتی با CFU پایینتر هم ارزش بالینی داشته باشد و کنار گذاشتن آن صرفاً بهخاطر شمارش کمتر، خطای تشخیصی ایجاد میکند. بنابراین اگر زمینه بالینی محتمل است و رشد یکنواخت دارید، باید افتراق لازم انجام شود.
برای کنترل کیفی و تفسیر تست کاتالاز (Catalase test):
کنترل کیفی تست کاتالاز: راهنمای جامع برای کارشناسان آزمایشگاه
برای اصول و کنترل کیفی تست کواگولاز (Coagulase test):
اصول، روش کار، تفسیر نتایج و کنترل کیفی تست کواگولاز
مسیر شناسایی مخمرها در رویکرد تشخیصی به کشت مثبت ادرار (Yeast Pathway)
مشاهده مخمر در ادرار غالباً به معنای candiduria است که در بسیاری موارد کلونیزاسیون یا مرتبط با کاتتر و مصرف آنتیبیوتیک است. تصمیم اصلی آزمایشگاه این است که آیا گونهگذاری لازم است یا خیر. در صورت نیاز، MALDI-TOF یا روشهای بیوشیمیایی/افتراقی به کار میروند، اما مهمتر از ID، نحوه گزارش و جلوگیری از درمان بیمورد است.
آنتیبیوگرام و گزارش قابل دفاع در رویکرد تشخیصی به کشت مثبت ادرار (AST & Reporting)
پس از شناسایی نهایی، باید تصمیم گرفته شود که آیا AST اندیکاسیون دارد یا خیر. AST فقط زمانی باید انجام شود که ارگانیسم بهعنوان پاتوژن محتمل و قابل درمان تشخیص داده شده باشد. انجام AST روی رشد مختلط یا مشکوک به آلودگی یک خطای سیستماتیک است. گزارش نهایی باید بازتابدهنده همین منطق باشد: شناسایی و AST برای اوروپاتوژن غالب و همخوان با UA، و درخواست نمونه جدید یا گزارش محافظهکارانه در سایر موارد.
برای اجرای درست آنتیبیوگرام دیسکی (Disk diffusion) و خطاهای رایج:
دیسک آنتی بیوگرام: راهنمای جامع تست حساسیت آنتی بیوتیکی
فلوچارت رویکرد تشخیصی به کشت مثبت ادرار (Algorithm / Flowchart)
Urinalysis (Dipstick ± Microscopy)
↓
Urine culture (calibrated loop, semi-quantitative)
↓
Interpret colonies:
- ≥100 colonies of ONE type → significant (≈≥10^5 CFU/mL)
- Two types: if ≥100 for ≥1 type → workup each ≥100 + request new sample
- >2 types → likely contaminated → request new sample
↓
Gram stain from dominant/pure colony
↓
GNR / GPC / Yeast
↓
Targeted Identification (Biochemical / MALDI / Automated)
↓
Clinical & UA Correlation Check
↓
Final Identification
↓
AST only when growth is clinically & microbiologically interpretable
نکته مهم: این فلوچارت وقتی به بهترین نتیجه میرسد که مرحله «کنترل همخوانی UA و منطق نمونه» را حذف نکنید؛ همان مرحلهای که از گزارشهای غیرقابل دفاع جلوگیری میکند.
SOP آزمایشگاهی در رویکرد تشخیصی به کشت مثبت ادرار (Final Identification & Reporting SOP)
هدف: استانداردسازی انتخاب کلنی، شناسایی نهایی و تصمیمگیری درباره AST.
روش اجرایی: پس از مشاهده رشد، الگوی کلنی از نظر تعداد مورفوتایپ و شمارش نیمهکمی بررسی میشود. رشد مختلط با بیش از دو مورفوتایپ در نمونههای معمول بهعنوان آلودگی تلقی شده و درخواست نمونه جدید صادر میگردد. در صورت وجود مورفوتایپ غالب با شمارش معنیدار، کلنی نماینده انتخاب و زیرکشت خالص تهیه میشود. از کلنی خالص Gram stain انجام شده و مسیر شناسایی (GNR، GPC یا Yeast) تعیین میگردد. شناسایی با روش موجود در آزمایشگاه (MALDI-TOF، سیستم اتومات یا بیوشیمی هدفمند) انجام میشود. پیش از نهاییسازی، همخوانی ID با نوع نمونه، UA و سناریوی بالینی بررسی میشود. AST فقط در صورت پاتوژن محتمل و قابل درمان انجام میگردد.
جمعبندی خفن: رویکرد تشخیصی به کشت مثبت ادرار یعنی حذف نویز و شکار پاتوژن واقعی
کشت مثبت ادرار یک نتیجه نیست؛ یک فرآیند تصمیمگیری است. ارزش واقعی آزمایشگاه در این است که از میان رشدهای متعدد، پاتوژن واقعی را تشخیص دهد و نویز را حذف کند. این کار با تست بیشتر انجام نمیشود، بلکه با منطق تشخیصی استاندارد انجام میشود. وقتی مسیر از پیشتحلیل تا شناسایی نهایی و AST بهصورت الگوریتمی و قابل دفاع طی شود، آزمایشگاه از یک تولیدکننده نتیجه خام به یک شریک واقعی در مراقبت بالینی تبدیل میشود. این دقیقاً همان نقطهای است که نقش کارشناس میکروبیولوژی از «فنی» به «تشخیصی» ارتقا پیدا میکند.
سوالات رایج درباره رویکرد تشخیصی به کشت مثبت ادرار (FAQ)
1) آیا هر کشت مثبت ادرار یعنی UTI؟
خیر. در رویکرد تشخیصی به کشت مثبت ادرار، مثبت بودن میتواند ناشی از آلودگی، کلونیزاسیون یا باکتریوری بدون علامت باشد و باید با Urinalysis و الگوی رشد تفسیر شود.
2) چرا زیرکشت خالص قبل از شناسایی نهایی مهم است؟
زیرا ناخالصی پنهان کلنی میتواند هم ID و هم AST را منحرف کند. زیرکشت خالص کیفیت گزارش را بالا میبرد.
3) در کشت نیمهکمی، ≥100 کلنی یعنی چه؟
با لوپ ۱ µL، ≥100 کلنی معمولاً معادل ≥10⁵ CFU/mL تلقی میشود و در بسیاری سناریوها رشد معنیدار محسوب میگردد.
4) اگر بیش از دو مورفوتایپ در کشت ادرار دیده شود چه کنیم؟
در اغلب موارد نمونه آلوده است و بهتر است درخواست نمونه جدید داده شود و از شناسایی کامل و AST اجتناب گردد.
5) نقش MacConkey در مسیر GNR چیست؟
MacConkey ابزار تصمیمگیری است؛ کلنی صورتی/قرمز به نفع Enterobacterales و کلنی بیرنگ مسیر non-fermenter را مطرح میکند.
6) چرا oxidase را «تقاطع» در GNR میدانیم؟
چون مسیر شناسایی را بین احتمال Pseudomonas (oxidase+) و Enterobacterales/برخی non-fermenterهای دیگر (oxidase-) جدا میکند و از تستهای اضافی جلوگیری میکند.
7) در GPC، چرا نباید سریع نتیجه را آلودگی فرض کنیم؟
چون Enterococcus و گاهی S. saprophyticus و S. aureus میتوانند پاتوژن واقعی باشند و بیتوجهی باعث خطای گزارش میشود.
8) AST را در چه شرایطی نباید انجام داد؟
روی رشد مختلط مشکوک به آلودگی یا رشدهای غیرقابل تفسیر (بدون همخوانی با UA/منطق نمونه) انجام AST میتواند درمان اشتباه ایجاد کند.
9) candiduria همیشه نیاز به گونهگذاری دارد؟
نه. در بسیاری موارد کلونیزاسیون است و تصمیم برای گونهگذاری باید بر اساس سیاست آزمایشگاه و اندیکاسیون بالینی باشد.
10) «مرحله مکث» قبل از گزارش یعنی چه؟
یعنی قبل از نهایی کردن ID/AST بررسی کنید ارگانیسم با نوع نمونه، الگوی رشد و UA سازگار است؛ این کار از گزارشهای غیرقابل دفاع جلوگیری میکند.
منابع معتبر برای مطالعه بیشتر (با لینک مستقیم)
• مقاله مرجع الگوریتم کممنبع و مسیر شناسایی (PMC):
Urinalysis in low-resource settings (PMC7602787)
