سلولهای بنیادی خون ساز: از مبانی مولکولی تا کاربردهای بالینی و آزمایشگاهی
سلول های بنیادی خون ساز (hematopoietic stem cells) جمعیت نادری با قابلیت خودنوسازی و تمایز چند رده ای هستند که مسئول خونسازی مادامالعمر بوده و پایهٔ تشخیص و درمان بسیاری از بیماریهای خونی بهشمار میآیند.
برای عضویت در کانال آموزشی در تلگرام به لینک زیر مراجعه کنید:
https://t.me/hematology_education
فهرست مطالب
دوره/مقاله مرتبط: هماتوپویز (hematopoiesis) — https://heamostica.com/hematopoiesis/
دوره جامع آموزش تصویری هماتولوژی فصل دوم: امبریوژنز، خون سازی، سلول های بنیادی خونساز و فاکتور های موثر بر آن — https://heamostica.com/basic-hematology-tests/
دوره جامع آموزش تصویری هماتولوژی فصل پنج: آزمایش های پایهای خون و مغز استخوان — https://heamostica.com/basic-hematology-tests/
چکیده جامع
سلول های بنیادی خون ساز (Hematopoietic Stem Cells یا HSCs) جمعیت نادری (حدود ۰٫۰۱-۰٫۰۵٪ سلولهای مغز استخوان) با قابلیت خودنوسازی و تمایز چند رده ای هستند که مسئول خونسازی در تمام طول عمر پستانداران میباشند. درک عمیق زیستشناسی این سلولها نه تنها اساس علوم هماتولوژی و ایمونولوژی است، بلکه پایه تشخیص و درمان بیماریهای بدخیم و غیربدخیم خونی را تشکیل میدهد. این مقاله با رویکردی تخصصی و آزمایشگاهی، به بررسی جامع ویژگیهای سلولی و مولکولی HSCs، روشهای شناسایی و جداسازی پیشرفته، ارزیابی عملکرد در شرایط In Vitro و In Vivo، و کاربردهای حیاتی آن در بالین میپردازد. هدف، ارائه مرجعی کاربردی برای متخصصان آزمایشگاهی است که در فرآیندهای تشخیصی، مانیتورینگ درمانی و تحقیقات مرتبط با سلولهای بنیادی نقش دارند.
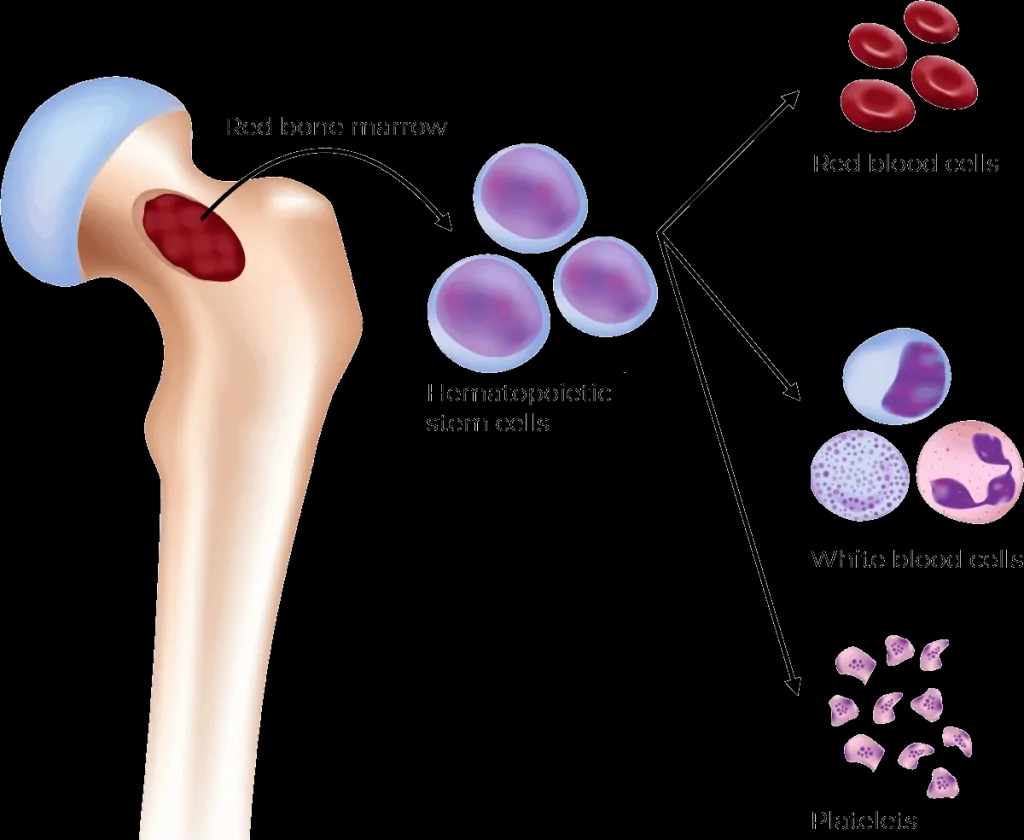
۱. مقدمه مفصل و ضرورت شناخت سلول های بنیادی خون ساز
سیستم خونساز یکی از پیچیدهترین و پویاترین سیستمهای بدن انسان است که روزانه حدود ۱۰¹¹ سلول جدید تولید میکند تا جایگزین سلولهای پیر شده و مرده شود. این سیستم سلسله مراتبی دقیقی دارد که در رأس آن سلول های بنیادی خونساز (HSCs) قرار گرفتهاند. اهمیت مطالعه HSCs در علوم آزمایشگاهی چندوجهی است:
از نظر تشخیصی: ناهنجاریهای عملکردی یا مولکولی HSCs میتواند منجر به طیف گستردهای از بیماریها شود:
- کمخونی آپلاستیک (Aplastic Anemia) (ناتوانی در تولید سلولهای خونی)
- سندرمهای میلودیسپلاستیک (Myelodysplastic Syndromes – MDS) (اختلال در تمایز)
- لوسمیهای حاد و مزمن (Acute/Chronic Leukemia) (تکثیر کنترلنشده و بلوغنیافته)
- نقایص اولیه ایمنی (Primary Immunodeficiency)
از نظر درمانی: پیوند سلولهای بنیادی خونساز (Hematopoietic Stem Cell Transplantation – HSCT) تنها درمان قطعی برای بسیاری از بیماریهای فوق و نیز تومورهای بدخیم مقاوم به درمان است.
از نظر تحقیقاتی: HSCs مدلی کلاسیک برای مطالعه مبانی زیستشناسی سلولهای بنیادی، از جمله مکانیسمهای خودنوسازی، تمایز، مهاجرت، و برهمکنش با ریزمحیط (نیچ) است.
شناخت دقیق نشانگرهای سطحی، فیزیولوژی و نیازهای کشت HSCs برای متخصص علوم آزمایشگاهی که مستقیم با پردازش، جداسازی، انجماد و ارزیابی نمونههای پیوندی سروکار دارد، یک ضرورت بالینی (clinical necessity) است.
۲. زیست شناسی سلول های بنیادی خون ساز: جزئیات سلولی و مولکولی
۲.۱. تکوین جنینی (Embryogenesis) و مهاجرت (Migration)
مسیر تکوینی HSCs در جنین انسان یک فرآیند پویا و مرحلهای است که از خارج از جنین آغاز میشود:
- مرحله کیسه زرده (Yolk Sac) (هفته ۲-۳ حاملگی): پیشسازهای اولیه خونساز (متعلق به رده پریمیتیو – primitive hematopoiesis) در جزایر خونساز کیسه زرده تشکیل میشوند. این سلولها عمدتاً برای خونسازی جنینی ضروری هستند و پتانسیل محدودی دارند.
- مرحله AGM (Aorta-Gonad-Mesonephros) (هفته ۴-۵): این مرحله کلیدی است. در ناحیه AGM، از سلولهای اندوتلیال آئورت (فرآیندی به نام هماتوژنز اندوتلیال – endothelial-to-hematopoietic transition) HSCs با پتانسیل کامل (تعریفشده با توانایی پیوند طولانیمدت – long-term engraftment capacity) ایجاد میشوند. نشانگرهای کلیدی این مرحله شامل Runx1 و GATA2 است.
- مهاجرت به کبد جنین (Fetal Liver) (از هفته ۶): HSCs به کبد جنین مهاجرت میکنند که تا زمان تولد به عنوان اندام خونساز اصلی عمل میکند. در این مرحله HSCs به سرعت تکثیر مییابند.
- مهاجرت نهایی به مغز استخوان (Bone Marrow) (از ماه چهارم حاملگی): در اواخر حاملگی، HSCs شروع به استقرار در حفرههای مغز استخوان میکنند. پس از تولد، مغز استخوان تنها محل خونسازی طبیعی (the only natural hematopoietic site) است.
۲.۲. سلسله مراتب (هیرارشی – Hierarchy) خونسازی
HSCs در راس یک سلسله مراتب انشعابی قرار دارد:
- سلول بنیادی خونساز (HSC): خودنوساز (self-renewing) و چندتوان (multipotent).
- پیشساز چندتوان (Multipotent Progenitor – MPP): خودنوسازی محدود، اما هنوز چندتوان.
- پیشسازهای اختصاصی رده (CLP و CMP):
- CLP (Common Lymphoid Progenitor): مولد لنفوسیتهای B، T و NK.
- CMP (Common Myeloid Progenitor): منشأ MEP (مگاکاریوسیت/اریتروئید – platelets & RBCs) و GMP (گرانولوسیت/مونوسیت).
این هیرارشی امروزه به مدل شبکهایتر “چارسکوم زمینچهر” (Landscape model) نزدیک میشود که مسیرهای تمایزی سیالتر و تحت تأثیر سیگنالهای محیطی هستند.
۲.۳. ریزمحیط (نیچ – Niche) مغز استخوان
HSCs در نیچ تخصصی مغز استخوان زندگی میکنند که برای حفظ ویژگی بنیادگی آنها حیاتی است. اجزای اصلی نیچ شامل:
- سلولهای استرومایی (stromal cells): استئوبلاستها (endosteal region)، سلولهای مزانشیمی (MSCs)، آدیپوسیتها.
- سلولهای اندوتلیال سینوسی: مسیر ورود/خروج از گردش خون.
- ماتریکس خارج سلولی (ECM): فیبرونکتین، کلاژن، هیالورونان.
- سیگنالهای مولکولی: SCF (Stem Cell Factor – kit ligand)، CXCL12 (SDF-1)/CXCR4، THPO (Thrombopoietin/MPL)، Ang-1، Wnt، Notch، Hedgehog.
- عصبی و متابولیک: اعصاب سمپاتیک و شرایط هیپوکسیک که از طریق HIF-1α عمل میکنند.
۲.۴. حالت ساکن (کوئیسانس – Quiescence) و خودنوسازی (Self-Renewal)
حدود ۷۵-۹۰٪ HSCs بالغ در فاز G0 چرخه سلولی (کوئیسانس) به سر میبرند. این حالت از انباشت آسیب ژنتیکی و پیری زودرس جلوگیری میکند و پتانسیل تکثیر طولانیمدت را حفظ مینماید. خودنوسازی تحت کنترل فاکتورهای رونویسی (RUNX1, HOXB4, ERG, MLL)، مسیرهای سیگنالینگ و تنظیمکنندههای اپیژنتیک است.
۳. روشهای شناسایی و جداسازی سلول های بنیادی خون ساز در آزمایشگاه
۳.۱. فلوسایتومتری چندپارامتری و پانلهای نشانگری
جداسازی HSCs خالص سنگبناي تمام تحقیقات و بسیاری از کاربردهای بالینی است.
HSCs انسانی:
- پانل کلاسیک: CD34+ CD38- CD90+ (Thy1) CD45RA- Lin- (Lin شامل CD2, CD3, CD11b, CD14, CD15, CD16, CD19, CD56, CD235a).
- پانلهای پیشرفته: اضافه کردن نشانگرهای منفی مانند CD49f، CD133، یا EPCR (CD201) برای افزایش خلوص. سلولهای CD34+ CD38- CD45RA- CD90+ CD49f+ بالاترین پتانسیل پیوند طولانیمدت را دارند.
- امروزه اکثر مراکز پیشرفته دنیا از پانل ۱۰–۱۲ رنگ (10–12 color panels) استفاده میکنند که شامل CD34⁺ CD38⁻ CD45RA⁻ CD90⁺ CD49f⁻/low (یا CD49f⁺ برای LT-HSC) + EPCR⁺ + CD133⁻/low است. میتوانید این را بهعنوان «پانل نسل جدید ۲۰۲۴–۲۰۲۵ (Next-Generation HSC Panel 2024–2025)» اضافه کنید.
۳.۲. تکنیکهای جداسازی غیرفلورسانسی
- مغناطیسی (MACS): روشی سریع و با خلوص خوب برای جداسازی جمعیتهای غنی از CD34+ برای کاربردهای بالینی.
- بر اساس ویژگیهای فیزیکی: اندازه سلول و چگالی؛ روشهایی مانند Ficoll-Hypaque برای جداسازی MNCs کاربردی باقی ماندهاند.
۴. آزمونهای عملکردی (Functional Assays): سنگ محک توانایی سلول های بنیادی خون ساز
۴.۱. آزمونهای In Vitro (در محیط کشت)
کشت لانگترم (LTC-IC):
اصل روش: کشت سلولهای مورد آزمون بر روی یک لایه تغذیهکننده (فیبروبلاست استرومایی مغز استخوان یا خط سلولی MS-5) به مدت ۵-۸ هفته. HSCs قادر به ایجاد و حفظ کانونهای خونساز در این لایه هستند.
روش قرائت: پس از ۵-۸ هفته، سلولهای کل کشت جمعآوری و در متیلسلولوز نیمهجامد کشت داده میشوند تا کلونیهای پیشساز (CFU) شمارش شوند.
آزمون CFU: سلولها در محیط نیمهجامد با سیتوکینهای SCF, EPO, GM-CSF, IL-3, TPO کشت داده میشوند و پس از ۱۴-۱۶ روز کلونیها شمرده میشوند.
۴.۲. آزمون In Vivo: آزمون طلایی پیوند (Transplantation Assay)
اصل کار: تزریق سلولها به موشهای میزبان تخلیهشده از مغز استخوان و مانیتورینگ engraftment کوتاهمدت و بلندمدت. پیوند ثانویه قویترین شاهد خودنوسازی HSCs است.
۵. کاربردهای بالینی و نقش حیاتی سلول های بنیادی خون ساز در علوم آزمایشگاهی
۵.۱. پیوند سلول های بنیادی خون ساز (HSCT)
منابع سلولی و پردازش آزمایشگاهی:
- مغز استخوان (Bone Marrow – BM): آسپیره شده از ایلیاک کرست؛ فیلتراسیون، جداسازی MNCs، شمارش و تستهای میکروبیولوژیک.
- خون محیطی (Peripheral Blood Stem Cells – PBSC): پس از تحریک با G-CSF؛ آفرز (Apheresis)، شمارش CD34+ و cryopreservation.
- خون بند ناف (Cord Blood – CB): پردازش، کاهش حجم، انجماد در نیتروژن مایع و تستهای عفونی/HLA.
۵.۲. نقش آزمایشگاه در HLA Typing و Chimerism Analysis
تکنیکها شامل PCR-SSP, PCR-SSO و NGS برای HLA؛ ردیابی پیوند با STR-PCR، فلوسایتومتری یا FISH است.
۵.۳. بیماریزایی و تشخیص آزمایشگاهی
LSCها (Leukemic Stem Cells) در AML قواعد مهمی برای پیشآگهی دارند (مثلاً پانل CD34+ CD38- CD123+).
۵.۴. ژنتراپی و سلولدرمانی (Gene Therapy & Cell Therapy)
HSCs بیمار جداشده، ویرایش یا ترانسداکشن میشوند و پس از کنترل کیفیت به بیمار بازگردانده میشوند. آزمایشگاه در تمام مراحل نقش حیاتی دارد.
اولین محصول تجاری مبتنی بر ویرایش ژنی CRISPR که به تأیید رسیده است برند CASGEVY™ (Exagamglogene autotemcel – exa-cel) نام دارد؛ تاریخهای کلیدی تصویب این محصول عبارتند از: تایید FDA در ۸ دسامبر ۲۰۲۳ (December 8, 2023) و تصویب/مجوز مشروط در اتحادیه اروپا در اوایل سال ۲۰۲۴ (European Commission / EMA – February 2024).
منبع: گزارش رسمی FDA و صفحه EPAR در EMA (لینکها در بخش منابع).
۶. چالشها، مباحث روز و افق آینده سلول های بنیادی خون ساز
بزرگنمایی HSCs در کشت (HSC expansion in culture): چالش اصلی حفظ خودنوسازی در حین تکثیر. ترکیبی از سیتوکینها (SCF, TPO, FLT3-L)، مولکولهای کوچک (UM171، SR1)، و کشت بر روی استرومای مصنوعی یا در بیورآکتورهای سهبعدی در حال مطالعه است.
ترکیب UM171 + SR1 در سالهای اخیر کمتر استفاده میشود و در پروتکلهای جدید clinical-grade از PVA-based serum-free medium (پلیوینیل الکل بهعنوان جایگزین آلبومین در محیط بدون سرم) همراه با UM171 یا از محیطهای بدون آلبومین (albumin-free media) + مولکولهای کوچک جدید استفاده میشود (مرجع: مقالات و مرورهای مرتبط ۲۰۲۳–۲۰۲۴). لینک منابع در بخش منابع انتهای صفحه آمده است.
نیچ مصنوعی، HSCs و پیری، تکسلولیشناسی (Single-Cell RNA-Seq, CyTOF) و متابولیسم HSCs از دیگر جهات مهم تحقیقاتی هستند.
۷. نتیجهگیری
سلولهای بنیادی خونساز محور اصلی خونسازی، تشخیص بیماریهای خونی و درمانهای پیشرفته مانند پیوند و ژنتراپی هستند. برای دانشجوی و متخصص علوم آزمایشگاهی، فراتر از شناخت تئوری، تسلط عملی بر فلوسایتومتری پیشرفته، تکنیکهای کشت سلولی تخصصی، روشهای مولکولی ردیابی پیوند، و پروتکلهای پردازش و نگهداری سلول یک مهارت حیاتی محسوب میشود. آینده پزشکی شخصیشده و درمانهای ریشهکنکننده بیماریهای خونی، در گرو دقت، تخصص و نوآوری در آزمایشگاههای سلولی و مولکولی است. بنابراین، پژوهش و آموزش مداوم در این حوزه برای ارتقای سطح کیفی خدمات تشخیصی و درمانی ضرورتی انکارناپذیر است.
سوالات رایج (FAQ) در مورد سلول های بنیادی خون ساز
سلول های بنیادی خون ساز (Hematopoietic Stem Cells) جمعیت نادری هستند که میتوانند خودنوسازی کنند و به تمام خطوط خونی تمایز یابند؛ اهمیت آنها در تشخیص بیماریهای خونی، پیوند، و ژندرمانی است.
CD34+ نشانگر پیشسازهای خونی است و CD38- مشخصه جمعیتهای رجوعیترHSC است؛ ترکیب CD34+ CD38- برای شناسایی جمعیت HSCs استفاده میشود.
آزمونهای In Vitro مانند LTC-IC و CFU و آزمونهای In Vivo مانند آزمون پیوند (transplantation assay) استانداردهای ارزیابی عملکرد HSC هستند.
BM مستلزم آسپیراسیون است، PBSC از طریق آفرز پس از G-CSF جمعآوری میشوند و CB از بند ناف در زمان تولد جمعآوری میشود؛ هرکدام مزایا و معایب خاص خود را دارند.
Casgevy (Exagamglogene autotemcel – exa-cel) اولین محصول مبتنی بر ویرایش CRISPR است که توسط FDA در ۸ دسامبر ۲۰۲۳ تأیید شد و در اتحادیه اروپا در فوریه ۲۰۲۴ تصویب/مجوز مشروط گرفت.
پانلهای کلاسیک شامل CD34+ CD38- CD90+ CD45RA- Lin- هستند؛ پانلهای نسل جدید ۱۰–۱۲ رنگ با CD49f، EPCR و CD133 دقت و خلوص بهتری ارائه میدهند.
UM171 مولکولی مؤثر است اما ترکیب UM171 + SR1 نسبت به پروتکلهای جدید (PVA-based serum-free media یا albumin-free + small molecules) بهطور فزایندهای جایگزین شدهاند.
روشهای استاندارد شامل STR-PCR برای تعیین درصد سلولهای دهنده، فلوسایتومتری و در موارد خاص FISH میباشند.
آزمایشگاه مسئول جداسازی سلول، ترانسداکشن/ویرایش، کنترل کیفیت، تستهای ایمنی و تعیین پتانسیل تومورزایی است.
منابع معتبر شامل مقالات مرور در Nature Medicine, Blood، پایگاههای FDA و EMA، و منابع آموزشی تخصصی همچون heamostica.com میباشند. فهرست منابع در انتهای صفحه آمده است.
منابع و مطالعه بیشتر
- FDA Press Release — FDA Approves First Cell-Based Gene Therapies (Casgevy) — FDA: Casgevy approval (Dec 8, 2023).
- EMA — CASGEVY EPAR — EMA: CASGEVY EPAR (Feb 2024).
- N Nature Communications (2023) — HSC expansion strategies
- Ren et al. (2024) — PVA-based medium + UM171.
- Blood / UM171 reviews and advances — Blood Advances / UM171 (2024).
- مقالات و دورههای آموزشی heamostica:
