کنترل کیفی گروه خونی | بانک خون، آنتیسرمهای ABO و Rh، تیتراسیون و چکلیست روزانه
خلاصه: کنترل کیفی گروه خونی مجموعهای از اقدامات استاندارد برای تضمین صحت گروهبندی ABO/Rh، غربالگری آنتیبادی، و کراسمچ در بانک خون است. این برنامه شامل کنترل روزانه آنتیسرمها، پایش دمای تجهیزات، تیتراسیون دورهای، حل اختلافهای ABO و مستندسازی کامل بوده و مستقیماً با ایمنی بیمار و انتخاب خون سازگار ارتباط دارد.
جهت عضویت در کانال آموزشی در تلگرام به لینک زیر مراجعه کنید:
https://t.me/hematology_education
فهرست مطالب
- بانک خون چیست؟ (تعریف، نقشها و الزامات)
- کنترل کیفی گروه خونی: اصول و معماری برنامه QC
- کنترل کیفی آنتیسرمهای ABO و Rh (Anti-A, Anti-B, Anti-D)
- تیتراسیون آنتیسرمهای گروه خونی
- کنترل گروهبندی مستقیم/معکوس و اختلافهای ABO
- غربالگری/شناسایی آنتیبادیهای غیرمنتظره (IAT)
- کنترل کیفی روزانه بانک خون (چکلیست)
- کراسمچ و کنترلهای مرتبط
- رفع اشکالهای پرتکرار
- مدیریت نمونه، ایمنی زیستی و ردیابی
- مستندسازی، SOP و آموزش
- محدودههای دمایی و پایش تجهیزات
- شاخصهای کیفیت و پایش عملکرد
- نکات طلایی آنتیسرمها و سلولهای معرف
- سوالات رایج (۱۰ سؤال/جواب)
- منابع معتبر
🏥 بانک خون چیست؟ (تعریف، نقشها و الزامات)
بانک خون بخشی تخصصی از آزمایشگاه است که مسئول تهیه، ذخیرهسازی، غربالگری، تطابق و توزیع خون و فرآوردههای خونی برای بیماران است. هدف اصلی بانک خون تضمین ایمنی گیرنده از طریق کاهش حداکثری ریسک ناسازگاریهای ایمونوهماتولوژیک و عفونتهاست.
وظایف کلیدی بانک خون
- تعیین گروه خونی و RhD (گروهبندی مستقیم و معکوس)
- کراسمچ و بررسی سازگاری (Immediate Spin، 37°C/آنتیگلوبولین، و در موارد مجاز Electronic Crossmatch)
- غربالگری و شناسایی آنتیبادیهای غیرمنتظره
- انتخاب و صدور خون/فرآورده مناسب (PRBC, FFP, Platelet, Cryo …)
- ذخیرهسازی و پایش دمایی تجهیزات (یخچال خون، فریزر، انکوباتور، سانتریفیوژ)
- اجرای برنامه جامع تضمین کیفیت (QC داخلی، اعتبارسنجی روشها، کنترلهای روزانه/دورهای، کالیبراسیون، آزمون مهارت EQA/PT)
- ردیابی و مستندسازی کامل از نمونه تا صدور (Traceability)
- آموزش و صلاحیتسنجی نیروی انسانی و بهروزرسانی SOPها
زیرساخت و تجهیزات پایه
- یخچال خون (2–6°C) با دیتالاگر و آلارم
- فریزر پلاسما (≤ −18°C یا بسته به نوع فرآورده)
- انکوباتور 37°C و حمام آب (در صورت نیاز)
- سانتریفیوژ با تایمر/ترمومتر (Tube/Gel)
- سیستم بارکد/ LIS برای ردیابی و کاهش خطای انسانی
- کیتها و معرفها (آنتیسرمها، سلولهای معرف A1/B/O، کوامبس، پانلهای آنتیژن/آنتیبادی)
🛡️ کنترل کیفی گروه خونی: اصول و معماری برنامه QC
کنترل کیفی مجموعه اقداماتی است که صحت، دقت، تکرارپذیری و قابلیت ردیابی نتایج را تضمین میکند. معماری یک برنامه QC موفق در بانک خون باید این لایهها را پوشش دهد:
- QC مواد و معرفها: آنتیسرمهای ABO/Rh، سلولهای معرف A1/B/O، AHG (پلی/مونو)، کنترلهای مثبت/منفی.
- QC محیط و تجهیزات: پایش دمای روزانه، کالیبراسیون دورهای، عملکرد سانتریفیوژ/انکوباتور.
- QC فرآیند: کنترلهای روزانه آزمونها، بررسی همسانی با نتایج گذشته (History Check)، قوانین پذیرش.
- اعتبارسنجی/تأیید روش: قبل از استقرار روش جدید یا تغییر مهم (Lot-to-Lot Verification).
- آموزش و ارزیابی صلاحیت کارکنان: ارزیابی دورهای مهارتها و خطایابـی.
- EQA/PT: شرکت در آزمون مهارت خارجی و اقدام اصلاحی بر اساس نتایج.
- مستندسازی و بازنگری: ثبت در فرمهای QC، نمودارهای روند (برای تیترها/شدت واکنش)، جلسات CAPA.
🔷 کنترل کیفی آنتیسرمهای سیستم گروه خونی ABO و Rh
اهداف QC آنتیسرمها
- تأیید اختصاصیت (عدم واکنش با سلول نامرتبط)
- تأیید حساسیت/قدرت واکنش (واکنش واضح با سلول هدف)
- پایش پایداری در طول زمان (تیتر/شدت آگلوتیناسیون)
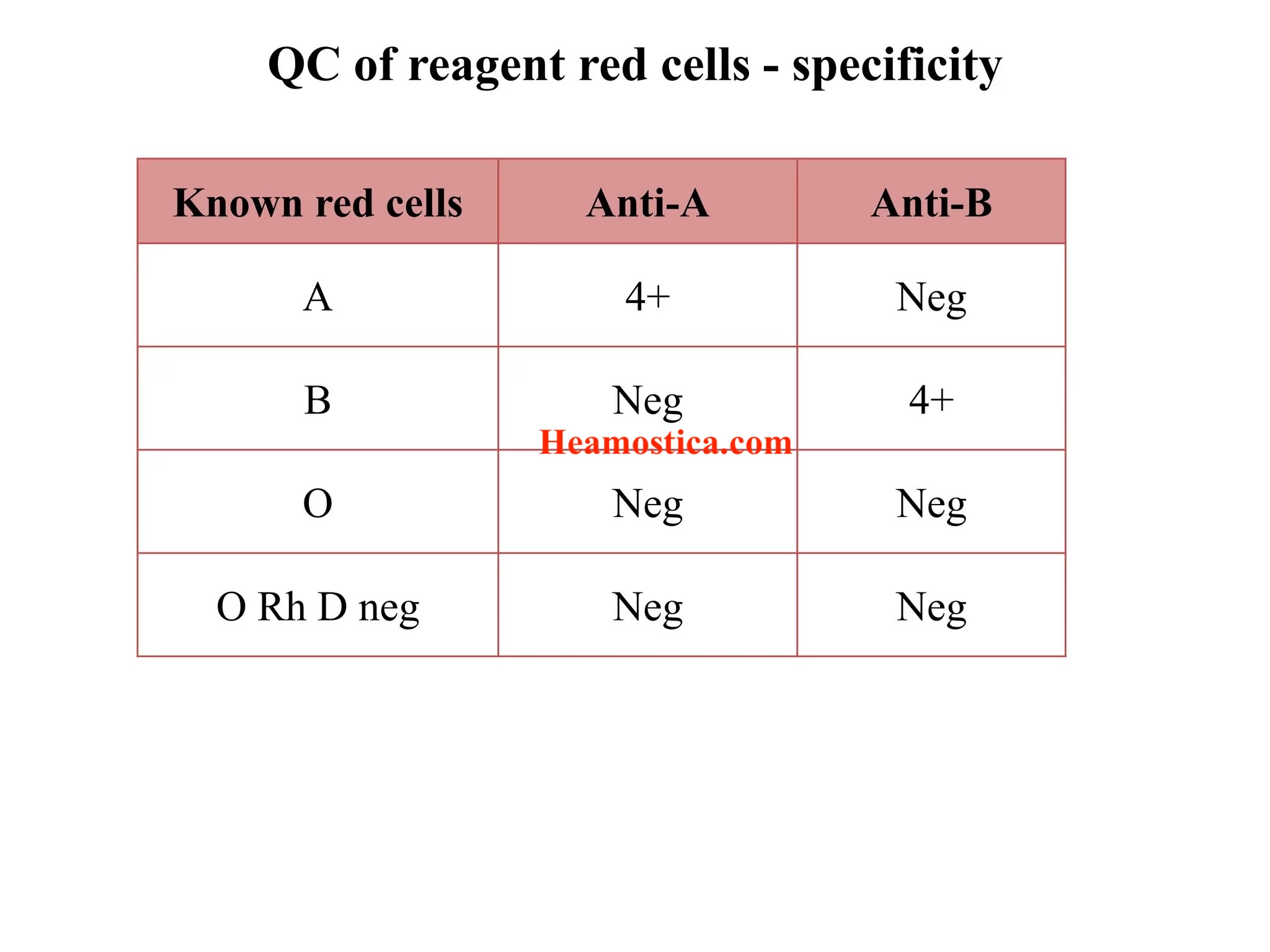
کنترل روزانه آنتیسرمهای ABO
- Anti-A: با سلول A (مثبت قوی) و B (منفی)
- Anti-B: با سلول B (مثبت قوی) و A (منفی)
- Anti-AB: با سلولهای A و B (مثبت)
- پذیرش: الگوی واکنش و شدت (مثلاً 3+ تا 4+) باید با روزهای قبل همخوان باشد؛ هر افت معنیدار نیازمند بررسی است (تخریب، آلودگی، خطای ذخیرهسازی).
کنترل روزانه آنتیسرمهای Rh (بهویژه Anti-D)
- با سلول D+ (مثبت) و D− (منفی)
- برای Anti-D تقویتشده، استفاده از Rh Control (کنترل منفی) برای اطمینان از عدم وجود واکنشهای غیرایمنی ضروری است.
- در موارد Weak D یا Partial D باید الگوریتم روشن باشد (37°C/AHG یا روشهای تأییدی).
شرایط نگهداری و نکات ایمنی
- معمولاً 2–8°C، پرهیز از انجماد و نور مستقیم.
- هرگونه کدورت، تغییر رنگ، لخته، رشد قارچی/باکتریایی = کنارگذاری و امحا.
- بطری قبل مصرف بهآرامی مخلوط شود.
- تاریخ انقضا و Batch/Lot در فرم QC ثبت گردد.
Cell Type / Back Type.
🧪 تیتراسیون آنتیسرمهای گروه خونی (پایش قدرت و پایداری) جهت کنترل کیفی گروه خونی
تیتراسیون روشی دورهای برای سنجش قدرت واکنشی آنتیسرمها و پایش افت قدرت در طول زمان است.
پروتکل پیشنهادی (Tube Method؛ قابل تطبیق با Gel)
- رقتهای دوتایی از آنتیسرم (1:2 تا 1:256 یا طبق SOP).
- افزودن سلولهای معرف استاندارد با غلظت 2–5%.
- انکوباسیون در دمای تعریفشده (RT برای ABO؛ در Rh بسته به کیت، ممکن است 37°C/آلبومین/آنزیم/AHG نیاز باشد).
- سانتریفیوژ طبق تنظیمات استاندارد.
- خوانش و درجهبندی شدت واکنش (0 تا 4+).
- تیتر = بالاترین رقتی که هنوز واکنش 1+ یا بالاتر دارد.
- ثبت و ترسیم روند (Trend)؛ افت بیش از ۱ لوله نسبت به مقدار پایه، نیازمند بررسی و معمولاً تکرار/اقدام اصلاحی است.
🧫 کنترل گروهبندی مستقیم/معکوس و اختلافهای ABO
گروهبندی مستقیم (Forward)
تست با Anti-A، Anti-B، (و در صورت نیاز Anti-AB). کنترلها: هر شیفت، با سلولهای شناختهشده A/B/O کیفیت آنتیسرمها تأیید شود.
گروهبندی معکوس (Reverse)
سرم/پلاسما بیمار در برابر سلولهای A1 و B. الگوی سازگار با Forward ضروری است؛ ناسازگاریها باید حل شوند.
علل شایع اختلاف ABO Discrepancy و رفع اشکال
- Rouleaux (هایپرویسکوزیته، پاراپروتئینمی): شستشوی سلولها/سالین.
- Cold Agglutinins: گرمکردن نمونه/سلولها، استفاده از محیط گرم.
- زیرگروههای A/B (مثل A2): استفاده از Anti-A1 و سلولهای A1/A2.
- نمونه نامناسب (همولیز، آلودگی، اختلاط): تکرار نمونهگیری، تأیید هویت.
- انتقال اخیر خون: توجه به تاریخچه و تفسیر با احتیاط.
- نوزادان و سالمندان: ضعف آنتیبادیهای معکوس.
راهنمای عدم تطابق گروهبندی ABO.
🧬 غربالگری و شناسایی آنتیبادیهای غیرمنتظره (IAT/Screen & ID)
- Antibody Screen با پانل سلولی 2 یا 3 سلولی؛ در صورت مثبتشدن، شناسایی با پانل توسعهیافته.
- کنترلها: AHG کنترل مثبت (Coombs Control Cells) و کنترل منفی.
- ثبت الگو (Phase: IS/37°C/AHG)، قوانین تفسیری (Rule-in/Rule-out)، و فنوتایپ/ژنوتایپ در صورت لزوم.
- گزارشدهی واضح برای انتخاب خون Antigen-negative.
🔁 کنترل کیفی روزانه بانک خون (چکلیست عملی)
چکلیست روزانه
- دمای یخچال خون (2–6°C)، فریزر پلاسما (≤ −18°C)، انکوباتور 37°C: ثبت هر شیفت + آلارمها.
- عملکرد آنتیسرمها با سلولهای کنترل مثبت/منفی (ABO/Rh).
- سلامت سلولهای معرف A1/B/O (عدم همولیز/آلودگی، تاریخ انقضا).
- کالیبراسیون ساده سانتریفیوژ (زمان/دور) طبق برنامه.
- اعتبار مواد مصرفی، تاریخ انقضا، Lot و ثبت Traceability.
- بازبینی نتایج با سوابق گذشته (History/Delta Check).
- تطابق هویت بیمار (حداقل دو شناسه؛ در انتقال خون: قانون ۲ نمونه در مراکز بسیاری توصیه/اجرا میشود).
- بازبینی SOPها/تغییرات و امضای شیفت.
هفتگی/ماهانه/دورهای
- تیتراسیون آنتیسرمها و ثبت روند.
- Lot-to-Lot Verification برای معرفهای جدید.
- تأیید کارایی AHG و Coombs Control Cells.
- اعتبارسنجی نرمافزار/Crossmatch الکترونیک (در مراکز دارای EM).
- EQA/PT و اقدامات اصلاحی (CAPA).
- کالیبراسیون رسمی تجهیزات توسط سرویسدهنده ذیصلاح.
🧷 کراسمچ و کنترلهای مرتبط
انواع کراسمچ
- Immediate Spin (IS): کشف ناسازگاری ABO (سرعتی).
- 37°C/AHG: کشف آنتیبادیهای IgG بالینی.
- Electronic Crossmatch: فقط در صورت وجود دو تعیین مستقل گروه ABO/Rh و Screen منفی و سیستم معتبر.
کنترلها
- برای روشهای حاوی AHG: حتماً Coombs Control Cells پس از منفیشدن گزارش شوند (Rule: منفی واقعی بودن فاز AHG تأیید گردد).
- در اورژانس: در صورت نیاز به صدور O RhD−، پروتکلهای استثنا، امضاها و ردیابی بهدقت رعایت شود.
🧩 رفع اشکالهای پرتکرار در بانک خون
- واکنش ضعیف یا غیرقابلپیشبینی با Anti-D: بررسی Weak D، استفاده از فاز 37°C/AHG، کنترل منفی (Rh Control)، بررسی Partial D.
- عدم تطابق Forward/Reverse: تکرار با سلولهای تازه، بررسی Rouleaux، زیرگروهها، تاریخچه انتقال/پیوند.
- Screen متناوباً مثبت/منفی: کیفیت پانل، دمای انکوباسیون، زمان سانتریفیوژ، هماتوکریت نمونه، داروها/IVIG.
- Positive Auto Control/DAT: خودایمنی، انتقال اخیر، داروها؛ به الگوریتم DAT (IgG/C3d) مراجعه شود.
- واکنشهای مشکوک در Gel/Tube: همارزیابی روش دیگر، بررسی فیبرین/خردهموکوس، شستوشوی کافی سلولها.
📦 مدیریت نمونه، ایمنی زیستی و ردیابی
- نمونهگیری صحیح با برچسب دوبخشی/بارکد و تطابق هویت در بالین.
- ضدعفونی و حمل ایمن، پرهیز از همولیز/آلودگی.
- Biosafety: PPE، دورریز ایمن، مدیریت حادثه Needle-stick.
- Traceability: ثبت زنجیره سرد، Lot معرفها، شماره کیسه خون، زمان صدور/بازگشت، گزارش عوارض انتقال (Hemovigilance).
📚 مستندسازی، SOP و آموزش
- هر تست دارای SOP امضاشده و نسخهدار باشد.
- فرمهای QC شامل تاریخ/زمان، اپراتور، Lot، دماها، نتایج، اقدامات اصلاحی.
- آموزش بدو خدمت و دورهای + ارزیابی صلاحیت (Direct Observation، آزمون کتبی/عملی).
- بازنگری دورهای SOPها بر اساس تغییرات کیت/استانداردها/بازخورد EQA.
🧊 محدودههای دمایی مرسوم و پایش تجهیزات
- یخچال خون: 2–6°C (آلارم <2 یا >6)
- فریزر پلاسما: ≤ −18°C (برای فریز بلندمدت ≤ −25°C ترجیحاً)
- انکوباتور: 37±0.5°C
- حمام آب: 37±1°C
- دیتالاگر با ثبت خودکار + بررسی شیفتی + آزمون آلارمها
🔍 شاخصهای کیفیت و پایش عملکرد
- نرخ اختلاف ABO (قبل/بعد از صدور)، نرخ واحدهای برگشتی، زمان Turnaround در اورژانس، نرخ خطاهای شناسایی، نتایج EQA/PT.
- تحلیل روند (Trend Analysis) و اجرای CAPA با ضربالاجل مشخص.
🧴 نکات طلایی برای آنتیسرمها و سلولهای معرف
- نگهداری در 2–8°C، دور از نور؛ عدم انجماد مگر قید سازنده.
- عدم استفاده پس از انقضا یا مشاهده هر آلودگی/کدورت.
- استفاده از کنترلهای مثبت/منفی در شروع هر شیفت و پس از باز کردن Lot جدید.
- ثبت Lot/Exp روی هر برگه کار + فرم QC.
- برای سلولهای A1/B: همولیز/رنگ غیرطبیعی = کنارگذاری؛ غلظت سلولی استاندارد حفظ شود.
❓ سوالات رایج درباره کنترل کیفی گروه خونی (۱۰ سؤال و جواب)
1) چرا کنترل کیفی گروه خونی حیاتی است؟
زیرا هر خطا در گروهبندی ABO/Rh و کراسمچ میتواند باعث همولیز و عوارض تهدیدکننده حیات شود. QC تضمینکننده صحت، دقت و تکرارپذیری نتایج است.
2) حداقل کنترلهای روزانه آنتیسرم چیست؟
برای Anti-A/Anti-B/Anti-AB و Anti-D با سلولهای مثبت/منفی مرتبط؛ تطابق شدت واکنش با روزهای قبل باید بررسی شود.
3) چه زمانی از Rh Control استفاده میکنیم؟
وقتی از Anti-D تقویتشده استفاده میشود تا واکنشهای غیرایمنی排除 گردد.
4) تیتراسیون آنتیسرم هر چند وقت انجام شود؟
طبق SOP مرکز (معمولاً ماهانه/فصلانه یا هنگام تغییر Lot) و هر زمان که افت قدرت مشکوک باشد.
5) اختلاف ABO را چگونه مدیریت کنیم؟
بررسی Rouleaux، سرماچسبها، زیرگروهها، کیفیت نمونه و تاریخچه انتقال؛ جزئیات در راهنمای عدم تطابق ABO.
6) چه زمانی Electronic Crossmatch مجاز است؟
زمانی که دو تعیین مستقل ABO/Rh موجود است، Antibody Screen منفی است و سیستم تاییدشده وجود دارد.
7) موارد Weak D را چگونه گزارش دهیم؟
طبق سیاست مرکز؛ ممکن است نیاز به مرحله 37°C/AHG یا گزارش خاص باشد. برای خوندهی معمولاً RhD− انتخاب میشود مگر شواهد قطعی.
8) شاخصهای کلیدی کیفیت در بانک خون کداماند؟
نرخ اختلاف ABO، واحدهای برگشتی، TAT اورژانس، خطاهای شناسایی، نتایج EQA/PT و روند CAPA.
9) نگهداری صحیح آنتیسرمها چگونه است؟
در 2–8°C، دور از نور، عدم انجماد؛ هر تغییر رنگ/کدورت نشاندهنده آلودگی است و باید کنار گذاشته شود.
10) برای بهبود مهارت تیم چه اقداماتی مؤثر است؟
آموزش بدو خدمت و دورهای، ارزیابی صلاحیت (مشاهده مستقیم/آزمون)، بازنگری SOP، و بازخورد مبتنی بر EQA/PT.
📚 منابع معتبر برای مطالعه بیشتر
- AABB Standards for Blood Banks and Transfusion Services, latest edition.
- Roback JD, et al. Technical Manual, AABB, latest edition.
✅ جمعبندی
کنترل کیفی در گروه خونی و بانک خون یک زنجیره بههمپیوسته از کنترل معرفها، تجهیزات، فرآیندها، آموزش و مستندسازی است. QC درست یعنی انتخاب خون درست برای بیمار درست در زمان درست—و این، مستقیماً با جان بیمار گره خورده است. با اجرای منظم QC روزانه/دورهای، تیتراسیون آنتیسرمها، حل اختلافهای ABO، و پایش تجهیزات، ریسک ناسازگاری به حداقل میرسد.
