روش انجام آزمایش رایت لوله ای: راهنمای جامع برای تشخیص بروسلوز
خلاصه: آزمایش رایت لوله ای (Standard Tube Agglutination Test – SAT) یک روش سرولوژیکی برای تشخیص عفونت بروسلا است که آنتی بادی ها را با استفاده از رقت های سریال سرم بیمار و آنتی ژن بروسلا اندازه گیری می کند. روش انجام آزمایش رایت لوله ای به شرح زیر است: جدا کردن سرم، تهیه رقت ها، افزودن آنتی ژن، انکوباسیون در 37 درجه سانتی گراد به مدت 18-24 ساعت، و ارزیابی آگلوتیناسیون . تیتر ≥1/160 معمولاً مثبت تلقی می شود و نتایج باید با علائم بالینی ترکیب شوند.
جهت عضویت در کانال آموزشی در تلگرام به لینک زیر مراجعه کنید:
https://t.me/hematology_education
فهرست مطالب: راهنما برای روش انجام آزمایش رایت لوله ای
- مقدمه: آشنایی با تست سرولوژیکی رایت لوله ای
- اصل آزمایش: مکانیسم آگلوتیناسیون در تشخیص بروسلا
- مواد مورد نیاز: تجهیزات و reagents برای انجام آزمایش رایت لوله ای
- روش انجام: مراحل گام به گام تست لوله ای رایت
- تفسیر نتایج: تحلیل تیترها در آزمایش تشخیص تب مالت
- احتیاط ها: نکات ایمنی در روش آزمایش رایت لوله ای
- کنترل کیفی: تضمین دقت در تست سرولوژیکی بروسلوز
مقدمه: آشنایی با تست سرولوژیکی رایت لوله ای برای تشخیص بروسلوز
آزمایش رایت لولهای (Standard Tube Agglutination Test – SAT یا Wright Test) یک تست سرولوژیکی کلاسیک برای تشخیص عفونت بروسلا (برسلوز یا تب مالت) است. این آزمایش آنتیبادیهای agglutinating (عمدتاً IgM و تا حدی IgG و IgA) علیه لیپوپلیساکارید صاف (S-LPS) بروسلا آبورتیس را شناسایی میکند. این تست به عنوان روش مرجع برای تشخیص سرولوژیکی بروسلوز شناخته میشود و در مناطق اندمیک، تیتر ≥1/160 یا ≥1/320 نشاندهنده عفونت فعال است. در مراحل اولیه عفونت، IgM غالب است و در موارد مزمن، IgG و IgA افزایش مییابد. این آزمایش ممکن است با پدیده پروزون (عدم آگلوتیناسیون در رقتهای پایین به دلیل مازاد آنتیبادی) همراه باشد، بنابراین رقتهای بالاتر (بیش از 1/320) ضروری است. نتایج باید با علائم بالینی، سابقه اپیدمیولوژیک و تستهای تکراری ترکیب شود، زیرا آنتیبادیها ممکن است پس از بهبودی باقی بمانند یا واکنشهای متقاطع با باکتریهای دیگر (مانند Yersinia enterocolitica O:9) ایجاد کنند. این تست برای عفونتهای ناشی از B. abortus، B. melitensis و B. suis مناسب است، اما برای B. canis (فنوتیپ خشن) کارایی ندارد. در موارد مشکوک به عفونت مزمن، از تستهای مکمل مانند 2ME یا Coombs استفاده شود.
اصل آزمایش: مکانیسم آگلوتیناسیون در تشخیص عفونت بروسلا با روش لوله ای
اصل آزمایش بر اساس واکنش آگلوتیناسیون مستقیم بین آنتیبادیهای موجود در سرم بیمار و آنتیژن بروسلا (سوسپانسیون باکتریهای کشتهشده با حرارت و فرمالدئید) است. این واکنش منجر به تشکیل تودههای قابل مشاهده (کلامپینگ) میشود که نشاندهنده حضور آنتیبادیهای agglutinating است. آنتیژن معمولاً از سویه B. abortus S19 یا سویههای مشابه تهیه میشود که S-LPS مشترک بین گونههای صاف بروسلا را دارد. در عفونت حاد، IgM ابتدا افزایش مییابد (قابل تشخیص از هفته اول)، سپس IgG و IgA (از هفته دوم به بعد) ظاهر میشوند. تست SAT عمدتاً IgM را تشخیص میدهد، اما در موارد مزمن ممکن است آنتیبادیهای non-agglutinating (مانند IgG ناقص) را از دست بدهد. برای رفع این مشکل، از اصلاحاتی مانند تست 2ME (که IgM را غیرفعال میکند و IgG را اندازهگیری میکند) استفاده میشود. پدیده پروزون ممکن است در عفونتهای اولیه یا با تیتر بالا رخ دهد، بنابراین رقتهای سریال تا سطوح بالا ضروری است. این تست حساسیت بالایی دارد اما ممکن است به دلیل واکنشهای متقاطع با باکتریهای دیگر (مانند Francisella tularensis، Salmonella، Vibrio cholerae) یا واکسیناسیون (مانند وبا) مثبت کاذب ایجاد کند. در تنظیمات آزمایشگاهی، تست باید با کنترلهای مثبت و منفی همراه باشد تا دقت تضمین شود.
مواد مورد نیاز: تجهیزات، reagents و لوازم برای روش انجام آزمایش رایت لوله ای
– سرم بیمار: جمعآوریشده در لوله ، اجازه دهید کامل لخته شود، سپس سانتریفیوژ کنید تا سرم جدا شود. سرم را در دمای 2-8 درجه سانتیگراد برای تست در 24 ساعت نگهداری کنید؛ برای نگهداری طولانیتر، در -20 درجه سانتیگراد فریز کنید. از نمونههای لیپمیک، همولیزشده یا گرمشده اجتناب کنید.
– آنتیژن رایت لولهای: سوسپانسیون بروسلا آبورتیس کشتهشده با حرارت و فرمالدئید (مانند سویه S19 یا 119-3)، با غلظت استاندارد (1:100 تا 1:1000 در سالین)، تنظیمشده بر اساس دانسیته نوری برای یکنواختی.
– سالین فیزیولوژیک (0.9% NaCl) یا بافر فسفات (pH 7.2) برای رقتسازی.
– لولههای آزمایش سرولوژیکی (حداقل 9 لوله همولیز 5 میلیلیتری، تمیز و خشک).
– پیپتهای اتوماتیک یا نیمهاتوماتیک برای اندازهگیری دقیق 10-1000 میکرولیتر و 1-10 میلیلیتر، همراه با تیپهای یکبار مصرف.
– انکوباتور تنظیمشده روی 37 درجه سانتیگراد.
– میکسر ورتکس برای هموژنیزاسیون.
– کنترل مثبت: سرم شناختهشده واکنشی (با تیتر معلوم، مانند کد 63240 Bio-Rad).
– کنترل منفی: سرم غیرواکنشی یا سالین.
– تجهیزات ایمنی: کابینت ایمنی بیولوژیکی کلاس II، دستکش یکبار مصرف، عینک و لباس محافظ برای جلوگیری از مواجهه با آنتیژن (که ممکن است عفونی باقی بماند اگر به درستی غیرفعال نشده باشد).
– مواد اضافی: آب مقطر برای شستشو، پارافیلم یا درپوش برای آببندی لولهها، ذرهبین یا آگلوتینوسکوپ برای خواندن دقیق، و سانتریفیوژ (اختیاری برای 5 دقیقه در 250 g به جای انکوباسیون طولانی).
روش انجام آزمایش رایت لوله ای: مراحل گام به گام و دستورالعمل تست لوله ای رایت برای تشخیص تب مالت
-قبل از انجام آزمایش،به مدت ۳۰ دقیقه معرف ها و کنترل های داخل کیت را به در دمای اتاق قرار دهید تا به دمای محیط برسد.
– قبل از انجام آزمایش ، ویال آنتی ژن رایت لوله ای را به خوبی تکان دهید تا یکنواخت شود.
-تعداد 9 لوله آزمایش را در جا لوله ای قرار داده و در لوله اول0.9 میلی لیتر سرم فیزیولوژی بریزید و به آن 100 میکرولیتر از سرم بیمار اضافه کنید.
-در بقیه ی لوله ها 0.5 میلی لیتر سرم فیزیولوژی بریزید.
-مقدار 0.5 میلی لیتر از لوله اول بردارید و به لوله دوم اضافه کنید سپس به خوبی مخلوط کنید و سپس مقدار 0.5 میلی لیتر از این لوله را به لوله سوم اضافه کنید و به همین ترتیب تا لوله آخر ادامه دهید و 0.5 میلی لیتر آخر را دور بریزید.
-به تمام لوله ها مقدار 0.5 میلی لیتر آنتی ژن رایت لوله ای اضافه کنید.
-به این صورت تیتر های 1:20-1:40 و 1:80 و … تهیه می شوند.
-از سرم های کنترل منفی و مثبت داخل کیت به عنوان نمونه های کنترل کیفی استفاده کنید.
-بعد از این مرحله، دهانه لوله ها را با پارافیلم مسدود کنید و لوله ها را به مدت بیست و چهار تا چهل و هشت ساعت در دمای 37 درجه انکوبه کنید.
– بعد از آن گذشتن این زمان، زیر نور چراغ لوله ها را از نظر آگلوتیناسیون بررسی کنید.
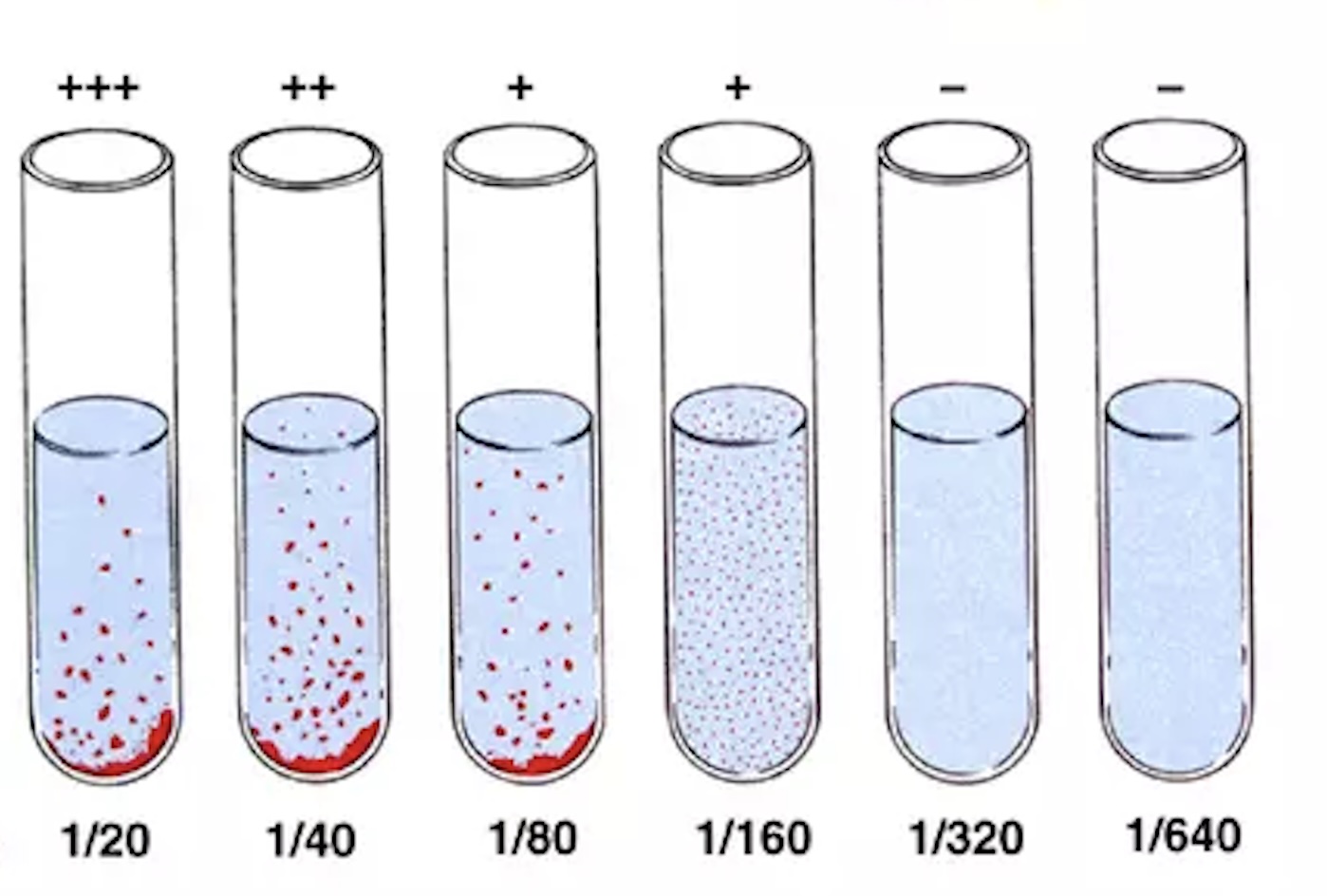
روش انجام آزمایش رایت لوله ای
تفسیر نتایج: تحلیل و ارزیابی تیترها در روش تشخیص بروسلوز با آزمایش رایت
-در ثبت نتایج باید دقت شود که واکنش آگلوتیناسیون با ته نشین باکتری ها که به صورت دکمه در ته لوله می باشد اشتباه نشود.
-تیتر های پائین 20/1 و 40/1 نباید کم اهمیت تلقی شوند و اگر با تظاهرات بالینی از قبیل درد استخوانی و مفصلی، تب و درد عضلانی و کمر درد و … همراه باشند تکرار آزمایش پس از دو هفته توصیه می گردد لذا تشخیص قطعی نوع بیماری علاوه بر انجام آزمایشات سرولوژیکی و در نظر گرفتن علائم بالینی،مستلزم بررسی اطلاعات دیگری چون کشت خون ،کشت مدفوع، شمارش گلبول های سفید و غیره است که از بیمار گزارش می گردد، بنابراین با توجه به اشکالاتی اعم از موارد مثبت کاذب یا منفی کاذب روش های سرولوژیکی را با توجه به کمک فراوانی که در تشخیص عفونت به پزشک معالج دارند لازمه تست های تکمیلی اشاره در فوق می نماید.
| رقت سرم | نمونه اول | نمونه دوم | نمونه سوم | |
|---|---|---|---|---|
| 1:20 | ++++ | ++++ | ++++ | |
| 1:40 | ++++ | +++ | ++++ | |
| 1:80 | +++ | ++ | ++++ | |
| 1:160 | ++ | + | ++++ | |
| 1:320 | – | – | +++ | |
| 1:640 | – | – | ++ | |
| 1:1280 | – | – | + | |
| 1:2560 | – | – | – | |
| 1:5120 | – | – | – | |
| تیتر سرم | 160 | 80 | 640 |
برای نمونههای مشکوک، آزمایش رایت باید حداقل سه بار در فاصله چند روز و تحت شرایط کاملاً یکسان تکرار شود تا تغییرات نسبی تیتر آگلوتینین در سرم خون، عفونت را تأیید کند. بنابراین، یک نتیجه مثبت سرولوژیکی به تنهایی عفونت را قطعی نمیکند.
اختلاف یک تیتر مثبت بین نتایج دو آزمایش از یک نمونه یا نمونههای سرم گرفتهشده در فواصل یک تا دو هفته (تحت شرایط یکسان)، میتواند ناشی از محدودیتها یا اشتباهات آزمایشگاهی باشد.
تفاوت تست کومبس و کومبس رایت
تست رایت (Wright Test)
اصل تست:
بر پایهی آگلوتیناسیون (تجمع آنتیژن و آنتیبادی) است. در این روش، سرم بیمار با آنتیژن باکتری Brucella مخلوط میشود. اگر آنتیبادیهای ضد بروسلا در سرم وجود داشته باشند، باعث آگلوتیناسیون قابل مشاهده میشوند.
کاربرد:
- تشخیص عفونت حاد بروسلا (بروسلوز حاد)
- بررسی وجود آنتیبادیهای کامل (اغلب از نوع IgM)
- برای مرحلهٔ اولیهٔ بیماری مناسب است
🧬 تست کومبس رایت (Coombs Wright Test)
اصل تست:
در این روش ابتدا تست رایت معمولی انجام میشود، سپس سرم کومبس (آنتیگلوبولین انسانی) اضافه میگردد تا آنتیبادیهای ناقص (غیرآگلوتینهکننده) از نوع IgG و IgA که در تست رایت معمولی دیده نمیشوند، آشکار شوند. جهت مطالعه ی جامع در مورد آزمایش کومبس رایت به لینک زیر مواجعه کنید:
روش انجام تست کومبس رایت برای تشخیص بروسلوز: راهنمای جامع برای کارشناسان آزمایشگاه
کاربرد:
- تشخیص عفونت مزمن یا کهنهٔ بروسلوز
- زمانی که تست رایت منفی یا تیتر آن پایین است ولی علائم بالینی وجود دارد
- برای شناسایی آنتیبادیهای ناقص (Incomplete antibodies)
✅ خلاصه تفاوت:
| ویژگی | رایت | کومبس رایت |
|---|---|---|
| نوع آنتیبادی قابل تشخیص | IgM (و کمی IgG) | IgG و IgA (ناقص) |
| مرحله بیماری | حاد | مزمن یا مزمنشده |
| اساس واکنش | آگلوتیناسیون مستقیم | آگلوتیناسیون غیرمستقیم با سرم کومبس |
احتیاط ها: نکات ایمنی و پیشگیری در اجرای روش آزمایش رایت لوله ای
-به منظور کنترل حساسیت و کیفیت آنتی ژن ها و رفع هرگونه شک و ابهام در ثبت نتیجه آزمایشات آنتی ژن مورد نظر را با سرم های کنترل و سرم بیمار به هر دو روش آگلوتیناسیون همزمان و در شرایط کاملا یکسان مورد آزمایش قرار دهید.
-کلیه آنتی ژن هایی که با سرم کنترل منفی واکنش مثبت نشان داده و با سرم کنترل مثبت به خوبی آگلوتینه نشوند و یا خود به خود آگلوتینه شوند فاقد ارزش مصرفی می باشند لذا آنتی ژن ها می بایست با سرم کنترل مثبت واکنشی با تیتر بالاتر از 160/1 و با سرم بیمار تیتر معینی از خود نشان می دهد.
-هیچ گونه واکنشی با سرم کنترل منفی نباید وجود داشته باشد. البته باید توجه داشت آنتی ژنی که با سرم منفی واکنش مثبت نشان دهد هرگز تیتر آن نباید بالای 80 باشد.
-نمونه سرم خون بیمار باید شفاف و عاری از ذرات قابل رویت و کدورت باشد.
-به تاریخ اعتبار آنتی ژن ها دقت نمایید.
-هیچ یک از معرف ها را رقیق نکنید.
-معرف ها را با یکدیگر مخلوط نکنید.
-هیچ یک از معرف ها را فریز نکنید.
– اطمینان حاصل کنید که لوله های مورد استفاده قبل از انجام آزمون تمیز و خشک است.
-از هرگونه تماس مستقیم با فرآورده بدون استفاده از دستکش به دلیل وجود فنل در ترکیبات آنتی ژن خودداری کنید .
-هرگونه محلول ریخته شده روی سطوح را توسط محلول هیپوکلریت سدیم 5% ، ضد عفونی کنید .
نتایج کاذب:
الف-مثبت کاذب:
یکی از مهمترین مسائلی که در ازمایشات سرولوژیکی وجود دارد قرابت آنتیژنیکی بعضی از میکروارگانیزمها با یکدیگر است. به عنوان مثال اغلب بروسلوز می تواند با فرانسیسلا تولارنسیس،عفونت های سالمونلا،ویبریوکلرا،یرسینیا انتروکولیتیکا،سراشیا مارسسنس،هموفیلوس آنفولانزا،سودوموناس آئروژینوزا،گروه A استرپتوکوک بتا همولیتیک و اشرشیا کلی و انگل مالاریا مثبت کاذب نشان می دهد.
افزایش شیوع سل(TB) در سارسر جهان،نشان می دهد که سل ممکن است منجر به واکنش مثبت کاذب سرولوژی بروسلوز شود.این ممکن است به دلیل شباهت بالینی نزدیک این دو عفونت باعث یک چالش تشخیصی شود و پزشکان باید سرم فعال بودن بروسلوز مثبت کاذب را در بیماران مبتلا به سل فعال در نظر بگیرند.
ب-منفی کاذب:
در مواردی که سرم خون بیمار بیش از حد تعادل غلظتی باشد که برای ایجاد واکنش آنتی ژن-آنتی بادی مورد نیاز است یانقص سیستم ایمنی وجود داشته باشد نتیجه گزارش منفی خواهد بود.
شرایط نگهداری و عمر قفسه ای:
دمای 2-8 درجه سانتی گراد و با رعایت زنجیره سرد به مدت 2 سال قابلیت مصرف دارد.
معدوم سازی:
-به منظور احتیاط و ممانعت ازآلودگی های ثانویه این محصول را مانند هر گونه فرآورده میکروبی و عفونت زا معدوم نمایید.
– از سرم تازه و غیرهمولیز استفاده کنید؛ نمونهها را در لولههای دربدار نگهداری کنید تا آلودگی جلوگیری شود.
– تمام مراحل را در کابینت ایمنی بیولوژیکی کلاس II انجام دهید تا از مواجهه با آنتیژن (که ممکن است عفونی باشد) جلوگیری شود؛ از دستکش، عینک و لباس محافظ استفاده کنید.
– از پیپتینگ با دهان اجتناب کنید؛ هر نمونه تیپ پیپت جدید استفاده شود.
– شیشهآلات را با آب مقطر شسته و خشک کنید یا از مواد یکبار مصرف استفاده کنید.
– در صورت مشکوک به پروزون، رقتهای بالاتر (بیش از 1/320) تست کنید.
– نتایج منفی در مراحل اولیه عفونت ممکن است؛ تست را 2-3 هفته بعد تکرار کنید.
– برای تمایز IgM/IgG، از تست 2ME موازی استفاده شود (با بافر حاوی 0.05 M 2ME).
– تست را با علائم بالینی و تستهای مکمل (مانند ELISA یا PCR) ترکیب کنید؛ در موارد pediatric یا مزمن، فازهای منفی طولانی ممکن است.
– مواد را در دمای مناسب نگهداری کنید؛ از تاریخ انقضا بررسی شود.
– در صورت تماس با نمونهها، آنها را عفونی در نظر بگیرید و پروتکلهای ایمنی را رعایت کنید.
کنترل کیفی تست راست: روش های تضمین کیفیت و دقت در تست استاندارد لوله ای آگلوتیناسیون برای بروسلوز
کنترل کیفی (Quality Control – QC) در آزمایش رایت لوله ای ضروری است تا دقت، تکرارپذیری و قابلیت اعتماد نتایج تضمین شود. این فرآیند شامل کنترل های داخلی روزانه، کنترل های خارجی دوره ای، و نظارت بر عملکرد تجهیزات و مواد است. کنترل های مثبت و منفی باید در هر batch تست (حداقل روزانه) گنجانده شوند تا عملکرد آنتی ژن و روش را ارزیابی کنند. تیتر کنترل مثبت باید در محدوده انتظار (معمولاً ± یک رقت دوبرابر از تیتر مرجع) باشد؛ اگر خارج از محدوده باشد، batch نامعتبر است و باید تکرار شود. کنترل منفی باید فاقد آگلوتیناسیون باشد تا آلودگی یا واکنش غیراختصاصی را رد کند. چارت های کنترل کیفی (مانند Levey-Jennings) برای ردیابی تیترهای کنترل در طول زمان استفاده شود، با محدودیت های بالا (UCL) و پایین (LCL) تنظیم شده در ±3 انحراف استاندارد از میانگین. انحراف سیستماتیک (مانند شیفت یا روند) باید بررسی و اصلاح شود. مواد (آنتی ژن، سرم کنترل) باید از تامین کنندگان معتبر تهیه شوند و تاریخ انقضا، شرایط نگهداری (معمولاً 2-8 درجه سانتی گراد) و یکنواختی (با دانسیته نوری) بررسی شوند. تجهیزات مانند انکوباتورها و پیپت ها باید کالیبره شوند (حداقل سالانه) و ثبت شوند. پرسنل باید آموزش دیده و مهارت آنها ارزیابی شود (مانند تست کور). برنامه های کنترل کیفی خارجی (EQA) مانند طرح های WHO یا CAP برای مقایسه بین آزمایشگاهی توصیه می شود. ثبت تمام مراحل QC، از جمله نتایج کنترل ها، اقدامات اصلاحی و تاریخ ها، الزامی است. در صورت شکست QC، علل احتمالی (مانند آلودگی، دمای نادرست، خطای انسانی) بررسی و مستند شوند. این رویکرد با استانداردهای ISO 15189 برای آزمایشگاه های پزشکی سازگار است و حساسیت و ویژگی تست SAT را حفظ می کند.
جهت مطالعه جانع در مورد کنترل کیفی تست رایت به لینک زیر مراجعه کنید:
کنترل کیفی تست رایت (Wright Test) | آموزش کامل روش، مراحل و خطاهای رایج
همچنین جهت مطالعه ی جامع در مورد کنترل کیفی در بخش میکروب شناسی به لینک زیر مراجعه کنید:
کنترل کیفی میکروب شناسی: اصول، روشها و استانداردهای عملکردی
سوالات رایج در مورد روش انجام آزمایش رایت لوله ای
1. آزمایش رایت لوله ای چیست؟
آزمایش رایت لوله ای یک تست سرولوژیکی برای تشخیص عفونت بروسلا است که آنتی بادی ها را با آگلوتیناسیون اندازه گیری می کند.
2. تیتر مثبت در این آزمایش چقدر است؟
تیتر ≥1/160 در مناطق غیراندمیک یا ≥1/320 در مناطق اندمیک معمولاً مثبت است، اما با علائم بالینی ترکیب شود.
3. پدیده پروزون در تست رایت چیست؟
عدم آگلوتیناسیون در رقت های پایین به دلیل مازاد آنتی بادی، که با رقت های بالاتر حل می شود.
4. کنترل های مورد نیاز در آزمایش کدامند؟
کنترل مثبت (سرم واکنشی) و منفی (سرم غیرواکنشی یا سالین) برای هر batch ضروری است.
5. چگونه سرم بیمار را غیرفعال کنیم؟
سرم را در 56 درجه سانتی گراد به مدت 30 دقیقه گرم کنید تا کمپلمان حذف شود.
6. تست 2ME چه نقشی دارد؟
برای تمایز IgG از IgM، IgM را غیرفعال می کند و تیتر IgG را در عفونت های مزمن اندازه گیری می کند.
7. آیا این تست برای همه گونه های بروسلا مناسب است؟
برای B. abortus، B. melitensis و B. suis مناسب است، اما برای B. canis کارایی ندارد.
8. دلایل مثبت کاذب در آزمایش رایت چیست؟
واکنش های متقاطع با باکتری هایی مانند Yersinia، Salmonella یا واکسیناسیون وبا.
9. چگونه نتایج را تفسیر کنیم؟
تیتر بالاترین رقت با آگلوتیناسیون ≥50% است؛ افزایش 4 برابری تیتر تأیید عفونت حاد است.
10. کنترل کیفی چگونه انجام می شود؟
با کنترل های روزانه، چارت های QC، کالیبراسیون تجهیزات و برنامه های EQA برای تضمین دقت.
